Exubera pro léčbu cukrovky
Název značky: Exubera
Obecný název: lidský inzulín
Dávková forma: inhalační prášek
Obsah:
Popis
Klinická farmakologie
Klinické studie
Indikace a použití
Kontraindikace
Varování
Opatření
Lékové interakce
Nežádoucí reakce
Předávkování
Dávkování a správa
Jak dodáván
Exubera, lidský inzulín [původ rDNA] Informace o pacientovi (v prosté angličtině)
Popis
Exubera® sestává z blistrů obsahujících inhalační prášek pro lidský inzulín, které se podávají pomocí Exubery® Inhalátor. Blistry Exubera obsahují lidský inzulín produkovaný technologií rekombinantní DNA využívající nepatogenní laboratorní kmen Escherichia coli (K12). Chemicky má lidský inzulín empirický vzorec C257H383N65Ó77S6 a molekulová hmotnost 5808. Lidský inzulín má následující primární aminokyselinovou sekvenci:
Exubera (lidský inzulín [původ rDNA]) Inhalační prášek je bílý až šedobílý prášek v blistru s jednotkovou dávkou (náplň, viz tabulka 1). Každý blistr Exubery s jednotkovou dávkou obsahuje 1 mg nebo 3 mg dávky inzulínu (viz tabulka 1) v a homogenní prášková formulace obsahující citrát sodný (dihydrát), mannitol, glycin a sodík hydroxid. Po vložení blistru Exubera do inhalátoru pacient pumpuje držadlo inhalátoru a poté stiskne tlačítko, čímž dojde k propíchnutí blistru. Inhalační prášek pro inzulín je poté dispergován do komory, což pacientovi umožňuje inhalovat aerosolizovaný prášek.
Za standardních testovacích podmínek in vitro dodává Exubera specifickou emitovanou dávku inzulínu z náustku inhalátoru (viz tabulka 1). Zlomek celkové hmotnosti částic je emitován jako jemné částice schopné dosáhnout hlubokých plic. V blistru může být uchováno až 45% obsahu blistru 1 mg a až 25% obsahu blistru 3 mg.
Tabulka 1: Nomenklatura a informace o dávce
| Vyplňte hmotu (mg prášek) |
Nominální dávka (mg inzulínu) |
Emit Dose*,†(mg inzulínu) |
Dávka jemných částicC,†(mg inzulínu) |
|---|---|---|---|
| |||
| 1.7 | 1.0 | 0.53 | 0.4 |
| 5.1 | 3.0 | 2.03 | 1.0 |
Skutečné množství inzulínu dodaného do plic bude záviset na individuálních faktorech pacienta, jako je profil inspiračního toku. In vitro, emitované aerosolové metriky nejsou ovlivněny při průtoku nad 10 l / min.
horní
Klinická farmakologie
Mechanismus účinku
Primární aktivitou inzulínu je regulace metabolismu glukózy. Inzulín snižuje koncentraci glukózy v krvi stimulací periferní absorpce glukózy kosterním svalem a tukem a inhibicí produkce glukózy v játrech. Inzulín inhibuje lipolýzu v adipocytu, inhibuje proteolýzu a zvyšuje syntézu proteinů.
Farmakokinetika
Vstřebávání
Exubera dodává inzulín orální inhalací. Inzulín je absorbován tak rychle, jak subkutánně, podávají rychle působící analogy inzulínu a rychleji než subkutánně podávaný pravidelný lidský inzulín zdravým osobám a pacientům s diabetem typu 1 nebo typu 2 (viz Obrázek 1).
Obrázek 1: Průměrné změny koncentrací volného inzulínu v séru (µU / ml) u pacientů s diabetem 2. typu Podávání jednotlivých dávek inhalačního inzulínu z Exubery (6 mg) a subkutánního pravidelného lidského inzulínu (18U)
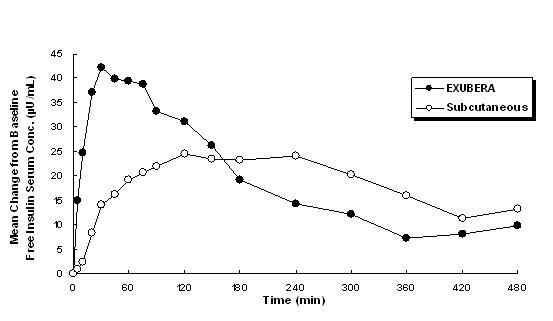
V klinických studiích u pacientů s diabetem 1. a 2. typu dosáhl sérový inzulín po inhalaci Exubery maximální koncentrace rychleji než po subkutánní injekci běžného lidského inzulínu, 49 minut (rozmezí 30 až 90 minut) ve srovnání se 105 minutami (rozmezí 60 až 240 minut), resp.
V klinických studiích absorpce subkutánního běžného lidského inzulinu klesala se zvyšujícím se indexem tělesné hmotnosti pacienta (BMI). Absorpce inzulínu po inhalaci Exubery však byla nezávislá na BMI.
Ve studii u zdravých jedinců byla systémová expozice inzulinu (AUC a Cmax) po podání Exubera se zvyšovala s dávkou v rozmezí 1 až 6 mg, když se podávala v kombinaci 1 a 3 mg puchýře.
Ve studii, kde byla dávková forma tří blistrů s obsahem 1 mg srovnávána s jedním blistrem o obsahu 3 mg, Cmax a AUC po podání tři blistry o obsahu 1 mg byly přibližně o 30% a 40% vyšší, než u blistrů po podání jednoho blistru o obsahu 3 mg (viz DÁVKOVÁNÍ A PODÁNÍ).
Distribuce a eliminace
Protože rekombinantní lidský inzulín je identický s endogenním inzulínem, očekává se, že systémová distribuce a eliminace budou stejné. To však nebylo pro Exuberu potvrzeno.
Farmakodynamika
Exubera, stejně jako subkutánně podávané rychle působící analogy inzulinu, má rychlejší nástup aktivity snižující hladinu glukózy než subkutánně podávané běžné lidské inzuliny. U zdravých dobrovolníků bylo trvání aktivity snižující hladinu glukózy u přípravku Exubera srovnatelné s podkožím podávané normální lidský inzulín a déle než subkutánně podávané rychle působící analogy inzulínu (viz Obrázek 2).
Obrázek 2. Průměrná míra infuze glukózy (GIR) Normalizovaná na GIRmax pro každý subjekt ošetření versus čas u zdravých dobrovolníků
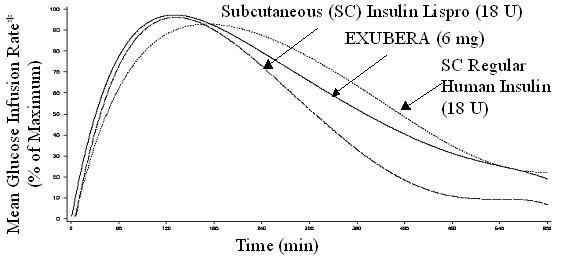
* Stanoveno jako množství infuze glukózy k udržení konstantní koncentrace glukózy v plazmě, normalizované na maximální hodnoty (procenta maximálních hodnot); svědčící o inzulínové aktivitě.
Při vdechnutí přípravku Exubera nastane nástup aktivity snižující hladinu glukózy u zdravých dobrovolníků během 10–20 minut. Maximální účinek na snížení hladiny glukózy se projeví přibližně 2 hodiny po inhalaci. Trvání aktivity snižující hladinu glukózy je přibližně 6 hodin.
U pacientů s diabetem 1. nebo 2. typu má přípravek Exubera v prvních dvou hodinách po podání dávky větší účinek na snížení hladiny glukózy ve srovnání s podkožně podávaným běžným lidským inzulínem.
Vnitřní variabilita aktivity Exubery na snižování hladiny glukózy je obecně srovnatelná s variabilitou subkutánně podávaného normálního lidského inzulínu u pacientů s diabetem 1. a 2. typu.
Zvláštní populace
Pediatričtí pacienti
U dětí (6-11 let) a adolescentů (12-17 let) s diabetem typu 1 byl čas do dosažení maximální koncentrace inzulínu pro Exuberu bylo dosaženo rychleji než u subkutánního běžného lidského inzulínu, což je v souladu s pozorováním u dospělých pacientů s typem 1 cukrovka.
Geriatričtí pacienti
Při porovnání pacientů ve věku nad 65 let a mladších dospělých nejsou zřejmé rozdíly ve farmakokinetických vlastnostech přípravku Exubera.
Rod
U subjektů s diabetem a bez diabetu nebyly pozorovány žádné zjevné rozdíly ve farmakokinetických vlastnostech Exubery mezi muži a ženami.
Závod
Byla provedena studie na 25 zdravých bělošských a japonských nediabetických subjektech za účelem porovnání farmakokinetické a farmakodynamické vlastnosti přípravku Exubera versus subkutánní injekce běžného člověka inzulín. Farmakokinetické a farmakodynamické vlastnosti přípravku Exubera byly mezi oběma populacemi srovnatelné.
Obezita
Absorpce Exubery je nezávislá na BMI pacienta.
Renální postižení
Účinek poškození ledvin na farmakokinetiku přípravku Exubera nebyl studován. U pacientů s renální dysfunkcí může být nezbytné pečlivé monitorování glukózy a úprava dávky inzulínu (viz OPATŘENÍ, Renální postižení).
Jaterní postižení
Účinek poškození jater na farmakokinetiku Exubery nebyl studován. U pacientů s jaterní dysfunkcí může být nezbytné pečlivé monitorování glukózy a úprava dávky inzulínu (viz OPATŘENÍ).
Těhotenství
Absorpce přípravku Exubera u těhotných pacientů s diabetem typu 2 a těhotenství před těhotenstvím byla v souladu s absorpcí přípravku Exubera u těhotných pacientů s diabetem 2. typu OPATŘENÍ).
Kouření
U kuřáků se očekává, že systémová expozice inzulínu Exubera bude 2 až 5krát vyšší než u nekuřáků. Exubera je kontraindikována u pacientů, kteří kouří nebo kteří přestali kouřit méně než 6 měsíců před zahájením léčby přípravkem Exubera. Pokud pacient začne kouřit nebo začne kouřit, musí být Exubera okamžitě přerušena kvůli zvýšenému riziku hypoglykémie a musí být použita alternativní léčba (viz KONTRAINDIKACE).
V klinických studiích s přípravkem Exubera u 123 pacientů (z toho 69 kuřáků) došlo u kuřáků k rychlejšímu nástupu účinku na snížení hladiny glukózy, větší maximální účinek a větší celkový účinek na snížení hladiny glukózy (zejména během prvních 2-3 hodin po podání) ve srovnání s nekuřáci.
Pasivní cigaretový kouř
Na rozdíl od zvýšení expozice inzulínu po aktivním kouření, když byl Exubera podán 30 zdravým nekuřáckým dobrovolníkům po 2 hodiny expozice pasivnímu cigaretovému kouři v kontrolovaném experimentálním prostředí byly AUC a Cmax inzulínu sníženy přibližně o 20% a 30%, resp. Farmakokinetika přípravku Exubera nebyla studována u nekuřáků, kteří jsou chronicky vystaveni pasivnímu cigaretovému kouři.
Pacienti s onemocněním plic
Použití přípravku Exubera u pacientů se základní plicní chorobou, jako je astma nebo CHOPN, se nedoporučuje, protože bezpečnost a účinnost přípravku Exubera v této populaci nebyla stanovena (viz bod 4.4). VAROVÁNÍ). Použití přípravku Exubera je kontraindikováno u pacientů s nestabilním nebo špatně kontrolovaným plicním onemocněním, a to kvůli širokému rozsahu variace plicních funkcí, které by mohly ovlivnit absorpci Exubery a zvýšit riziko hypoglykémie nebo hyperglykémie (viz KONTRAINDIKACE).
Ve farmakokinetické studii u 24 nediabetických jedinců s mírným astmatem absorpce inzulínu po podání Exubera byla v nepřítomnosti léčby bronchodilatátorem přibližně o 20% nižší než absorpce pozorovaná u subjektů bez astma. Ve studii u 24 nediabetických jedinců s chronickou obstrukční plicní nemocí (COPD) je však systémová expozice po podání Exubery byla přibližně dvakrát vyšší než u normálních subjektů bez CHOPN (viz OPATŘENÍ).
Podávání albuterolu 30 minut před podáním Exubery u nediabetických osob s mírným astmatem (n = 36) a středně těžkým astma (n = 31) vedla k průměrnému zvýšení AUC a Cmax inzulínu mezi 25 a 50% ve srovnání s tím, kdy byl Exubera podáván samostatně (viz OPATŘENÍ).
horní
Klinické studie
Bezpečnost a účinnost přípravku Exubera byla studována přibližně u 2 500 dospělých pacientů s diabetem 1. a 2. typu. Primárním parametrem účinnosti pro většinu studií byla kontrola glykémie, měřeno snížením hemoglobinu A1c (HbA1c) oproti výchozím hodnotám.
Diabetes 1. typu
U pacientů s diabetem typu 1 byla provedena 24-týdenní, randomizovaná, otevřená, aktivní kontrolní studie (studie A), aby se vyhodnotila bezpečnost a účinnost přípravku Exubera podávána před jídlem třikrát denně (TID) s jednou noční injekcí Humulin® U Ultralente® (lidská inzulínová prodloužená zinková suspenze) (n = 136). Srovnávací léčbou byl subkutánní normální lidský inzulín podávaný dvakrát denně (BID) (před snídaní a před večeří) s BID injekcí lidského inzulínu NPH (suspenze lidského inzulínu isofanu) (n = 132). V této studii byl průměrný věk 38,2 let (rozmezí: 20–64) a 52% subjektů byly muži.
Druhá 24-týdenní, randomizovaná, otevřená, aktivní kontrolní studie (studie B) byla provedena u pacientů s diabetem 1. typu k posouzení bezpečnost a účinnost přípravku Exubera (n = 103) ve srovnání s běžným subkutánním lidským inzulínem (n = 103) při podání TID před jídla. V obou léčebných ramenech byl lidskému inzulinu NPH podán BID (ráno a před spaním) jako bazální inzulín. V této studii byl průměrný věk 38,4 let (rozmezí: 19–65) a 54% subjektů bylo mužů.
V každé studii bylo snížení HbA1c a míry hypoglykémie srovnatelné pro obě léčené skupiny. U pacientů léčených Exuberou došlo k většímu snížení plazmatické glukózy nalačno než u pacientů ve srovnávací skupině. Procento pacientů, kteří dosáhli hladiny HbA1c <8% (na akci léčby American Diabetes Association Action) Hladina v době provádění studie) a hladina HbA1c <7% byla mezi oběma léčebnými skupinami srovnatelná. Výsledky studií A a B jsou uvedeny v tabulce 2.
Tabulka 2: Výsledky dvou 24týdenních, aktivních kontrolních, otevřených testů u pacientů s diabetem 1. typu (studie A a B)
| Studie A | Studie B | |||
|---|---|---|---|---|
| Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) | Exubera (TID) + NPH (BID) | SC R (TID) + NPH (BID) | |
| Velikost vzorku | 136 | 132 | 103 | 103 |
| UL = humulin® U Ultralente®; SC R = subkutánní normální lidský inzulín | ||||
| ||||
| HbA1c (%) | ||||
| Střední hodnota | 7.9 | 8.0 | 7.8 | 7.8 |
| Adj. průměrná změna oproti základní hodnotě | -0.2 | -0.4 | -0.3 | -0.2 |
| Exubera minus SCR* | 0.14 | -0.11 | ||
| 95% CI pro rozdíl v léčbě | (-0.03, 0.32) | (-0.30, 0.08) | ||
| Plazmatická glukóza nalačno (mg / dl) | ||||
| Střední hodnota | 191 | 198 | 178 | 191 |
| Adj. průměrná změna oproti základní hodnotě | -32 | -6 | -23 | 13 |
| Exubera minus SCR | -27 | -35 | ||
| 95% CI pro rozdíl v léčbě | (-47, -6) | (-58, -13) | ||
| 2hodinová postprandiální koncentrace glukózy (mg / dl) | ||||
| Střední hodnota | 283 | 305 | 273 | 293 |
| Adj. průměrná změna oproti základní hodnotě | -21 | 14 | -1 | -3 |
| Exubera minus SCR | -35 | 2 | ||
| 95% CI pro rozdíl v léčbě | (-61, -8) | (-29, 32) | ||
| Pacienti s HbA na konci studie1c < 8%†| 64.0% | 68.2% | 74.8% | 66.0% |
| Pacienti s HbA na konci studie1c < 7% | 16.9% | 19.7% | 28.2% | 30.1% |
| Tělesná hmotnost | ||||
| Základní průměr (kg) | 77.4 | 76.4 | 76.0 | 76.9 |
| Adj. průměrná změna oproti základní hodnotě (kg) | 0.4 | 1.1 | 0.4 | 0.6 |
| Exubera minus SCR | -0.72 | -0.24 | ||
| 95% CI pro rozdíl v léčbě | (-1.48, 0.04) | (-1.07, 0.59) | ||
| Na konci studie denní dávka inzulínu | ||||
| Krátkodobě působící inzulín | 13,4 mgC | 18,3 IU | 10,9 mgC | 25,7 IU |
| Dlouhodobě působící inzulín | 26,4 IU | 37,1 IU | 31,5 IU | 31,9 IU |
Diabetes typu 2
Monoterapie u pacientů, kteří nejsou optimálně kontrolováni dietou a cvičením
U pacientů s diabetem typu 2 nebyla optimálně provedena 12-týdenní, randomizovaná, otevřená, aktivní kontrolní studie (studie C). kontrolována dietou a cvičením, hodnocení bezpečnosti a účinnosti před jídlem TID Exubera (n = 75) ve srovnání s a látka zvyšující citlivost na inzulín. V této studii byl průměrný věk 53,7 let (rozmezí: 28–80), 55% subjektů bylo mužů a průměrný index tělesné hmotnosti byl 32,3 kg / m.2.
Ve 12 týdnech HbA1c hladiny u pacientů léčených přípravkem Exubera se snížily o 2,2% (SD = 1,0) z výchozí hodnoty 9,5% (SD = 1,1). Podíl pacientů léčených přípravkem Exubera na dosažení HbA na konci studie1c hladina <8% se zvýšila na 82,7%. Podíl pacientů léčených přípravkem Exubera na dosažení HbA na konci studie1c úroveň něčeho
Monoterapie a doplňková terapie u pacientů dříve léčených perorálními agenty
U pacientů s typem byla provedena 12-týdenní, randomizovaná, otevřená, aktivní kontrolní studie (studie D) 2 diabetici, kteří byli v současné době léčeni, ale byli špatně kontrolovaní, se dvěma perorálními přípravky (OA). Výchozí OA zahrnovaly sekretagog inzulinu a buď metformin nebo thiazolidindion. Pacienti byli randomizováni do jedné ze tří ramen: pokračování samotné OA terapie (n = 96), přechod na TID Exubera před jídlem (n = 102) nebo přidání TID Exubera před jídlem k pokračující léčbě OA (n = 100). V této studii byl průměrný věk 57,4 let (rozmezí 33–80), 66% subjektů bylo mužů a průměrný index tělesné hmotnosti byl 30 kg / m2.
Monoterapie Exubera a Exubera v kombinaci s OA terapií byly při snižování HbA lepší než samotné OA terapie1c úrovně od základní hodnoty. Míra hypoglykémie pro dvě léčené skupiny Exubera byla mírně vyšší než ve skupině léčené samotnou OA. Ve srovnání se samotnou terapií OA procento pacientů, kteří dosáhli HbA1c hladina <8% (na akční úroveň American Diabetes Association Action Level v době provádění studie) a HbA1c hladina <7% byla vyšší u pacientů léčených monoterapií Exubera a Exubera v kombinaci s léčbou OA. U pacientů v obou léčených skupinách Exubera došlo k většímu snížení plazmatické glukózy nalačno než u pacientů léčených samotnou OA terapií. Výsledky studie D jsou uvedeny v tabulce 3.
Tabulka 3: Výsledky 12týdenní, aktivní kontroly, otevřené zkoušky u pacientů s diabetem typu 2, které nejsou optimálně kontrolovány terapií duálními orálními agenty (studie D)
| Studie D | Exubera monoterapie | OAs* | Exubera + OA |
|---|---|---|---|
| Velikost vzorku | 102 | 96 | 100 |
| |||
| HbA1c (%) | |||
| Střední hodnota | 9.3 | 9.3 | 9.2 |
| Adj. průměrná změna oproti základní hodnotě | -1.4 | -0.2 | -1.9 |
| Skupina Exubera minus OA†| -1.18†,C, § | -1.67†, ¶, § | |
| 95% CI pro rozdíl v léčbě | (-1.41, -0.95) | (-1.90, -1.44) | |
| Plazmatická glukóza nalačno (mg / dl) | |||
| Střední hodnota | 203 | 203 | 195 |
| Adj. průměrná změna oproti základní hodnotě | -23 | 1 | -53 |
| Skupina Exubera minus OA | -24C | -53 ¶ | |
| 95% CI pro rozdíl v léčbě | (-36, -11) | (-66, -41) | |
| Pacienti s HbA na konci studie1c < 8%# | 55.9% | 18.8% | 86.0% |
| Pacienti s HbA na konci studie1c < 7% | 16.7% | 1.0% | 32.0% |
| Tělesná hmotnost | |||
| Základní průměr (kg) | 89.5 | 88.0 | 88.6 |
| Adj. průměrná změna oproti základní hodnotě (kg) | 2.8 | 0.0 | 2.7 |
| Skupina Exubera minus OA | 2.80C | 2.75 ¶ | |
| 95% CI pro rozdíl v léčbě | (1.94, 3.65) | (1.89, 3.61) |
U pacientů s diabetem typu 2, kteří v současné době dostávají sulfonylmočovinu, byla provedena 24-týdenní, randomizovaná, otevřená, aktivní kontrolní studie (studie E). Tato studie byla navržena k posouzení bezpečnosti a účinnosti přidávání přípravku Exubera před jídlem, aby se pokračovalo terapie sulfonylmočovinou (n = 214) ve srovnání s přidáním metforminu před jídlem k pokračující léčbě sulfonylmočovinou (n = 196). Subjekty byly stratifikovány podle HbA1c v týdnu -1. Byly definovány dvě vrstvy: nízká vrstva HbA1c (HbA1c 8% až 9,5%) a vysoká HbA1c vrstva (HbA1c > 9,5 až 12%).
Exubera v kombinaci se sulfonylmočovinou byla lepší než metformin a sulfonylmočovina při snižování hodnot HbA1c od výchozí hodnoty ve skupině s vysokou vrstvou. Exubera v kombinaci se sulfonylmočovinou byla srovnatelná s metforminem v kombinaci se sulfonylmočovinou při snižování hodnot HbA1c od výchozí hodnoty ve skupině s nízkou vrstvou. Míra hypoglykémie byla vyšší po přidání Exubery k sulfonylmočovině než po přidání metforminu k sulfonylmočovině. Procento pacientů, kteří dosáhli cílových hodnot HbA1c 8% a 7%, bylo srovnatelné mezi léčebnými skupinami v obou vrstvách, stejně jako snížení plazmatické glukózy nalačno (viz viz Tabulka 4).
Další 24-týdenní, randomizovaná, otevřená, aktivní kontrolní studie (studie F) byla provedena u pacientů s diabetem 2. typu, kteří v současné době dostávají metforminovou terapii. Tato studie byla navržena k posouzení bezpečnosti a účinnosti přidávání přípravku Exubera před jídlem, aby se pokračovalo terapie metforminem (n = 234) ve srovnání s přidáním glibenklamidu před jídlem k pokračující léčbě metforminem (n = 222). Subjekty v této studii byly také stratifikovány do jedné ze dvou vrstev, jak je definováno ve studii E.
Exubera v kombinaci s metforminem byla při snižování HbA lepší než glibenklamid a metformin1c hodnoty od základní hodnoty a dosažení cílové HbA1c hodnoty ve skupině s vysokou vrstvou. Exubera v kombinaci s metforminem byla při snižování HbA srovnatelná s glibenklamidem v kombinaci s metforminem1c hodnoty od základní hodnoty a dosažení cílové HbA1c hodnoty ve skupině s nízkou vrstvou. Míra hypoglykémie byla mírně vyšší po přidání Exubery k metforminu než po přidání glibenklamidu k metforminu. Snížení plazmatické glukózy nalačno bylo mezi léčebnými skupinami srovnatelné (viz Tabulka 4).
Tabulka 4: Výsledky dvou 24týdenních, aktivních kontrolních, otevřených testů u pacientů s diabetem typu 2 dříve na terapii perorálními agenty (studie E a F)
| Studie E | Studie F | |||||||
|---|---|---|---|---|---|---|---|---|
| Exubera + SU* | Se setkal*+ SU* | Exubera + SU* | Se setkal*+ SU* | Exubera + Met* | Gli* + Met* | Exubera + Met* | Gli* + Met* | |
| Vysoká vrstva†| Nízká vrstva†| Vysoká vrstva†| Nízká vrstva†| |||||
| Velikost vzorku | 113 | 103 | 101 | 93 | 109 | 103 | 125 | 119 |
| ||||||||
| HbA1c (%) | ||||||||
| Střední hodnota | 10.5 | 10.6 | 8.8 | 8.8 | 10.4 | 10.6 | 8.6 | 8.7 |
| Adj. průměrná změna oproti základní hodnotě | -2.2 | -1.8 | -1.9 | -1.9 | -2.2 | -1.9 | -1.8 | -1.9 |
| Exubera mínus OAC | -0.38C, § | -0.07 | -0.37C, ¶ | 0.04 | ||||
| 95% CI pro rozdíl v léčbě | (-0.63, -0.14) | (-0.33, 0.19) | (-0.62, -0.12) | (-0.19, 0.27) | ||||
| Plazmatická glukóza nalačno (mg / dl) | ||||||||
| Střední hodnota | 241 | 237 | 197 | 198 | 223 | 243 | 187 | 196 |
| Průměrná změna oproti základní linii | -46 | -47 | -48 | -52 | -42 | -40 | -46 | -49 |
| Exubera mínus OA | 1 | 4 | -2 | 4 | ||||
| 95% CI pro rozdíl v léčbě | (-11, 12) | (-8, 16) | (-14, 10) | (-7, 15) | ||||
| Subjekty s koncem studie HbA1c < 8%# | 48.7% | 44.7% | 81.2% | 73.1% | 72.5% | 56.3% | 80.8% | 86.6% |
| Subjekty s koncem studie HbA1c < 7% | 20.4% | 14.6% | 30.7% | 32.3% | 33.9% | 17.5% | 40.0% | 42.9% |
| Tělesná hmotnost | ||||||||
| Základní průměr (kg) | 80.8 | 79.5 | 79.9 | 81.9 | 88.3 | 87.8 | 90.3 | 88.2 |
| Adj. průměrná změna oproti základní hodnotě (kg) | 3.6 | -0.0 | 2.4 | -0.3 | 2.8 | 2.5 | 2.0 | 1.6 |
| Exubera mínus OA | 3.60 | 2.67 | 0.26 | 0.38 | ||||
| 95% CI pro rozdíl v léčbě | (2.81, 4.39) | (1.84, 3.51) | (-0.70, 1.21) | (-0.52, 1.27) |
Použití u pacientů dříve léčených subkutánním inzulínem
U pacientů léčených inzulinem typu 2 byla provedena 24-týdenní, randomizovaná, otevřená, aktivní kontrolní studie (studie G). diabetu k posouzení bezpečnosti a účinnosti přípravku Exubera podávaného před jídlem TID s jednou noční injekcí Humulin® U Ultralente® (n = 146) ve srovnání s běžným subkutánním lidským inzulínem podávaným BID (před snídaní a před večeří) s BID injekcí lidského inzulinu NPH (n = 149). V této studii byl průměrný věk 57,5 let (rozmezí 23–80), 66% subjektů bylo mužů a průměrný index tělesné hmotnosti byl 30,3 kg / m.2.
Snížení oproti základní hodnotě v HbA1c, procento pacientů, kteří dosáhli HbA1c hladina <8% (na akční úroveň American Diabetes Association Action Level v době provádění studie) a HbA1c hladina <7%, stejně jako míry hypoglykémie, byly mezi léčenými skupinami podobné. U pacientů léčených Exuberou došlo k většímu snížení plazmatické glukózy nalačno než u pacientů ve srovnávací skupině. Výsledky studie G jsou uvedeny v tabulce 5.
Tabulka 5: Výsledky 24týdenní, aktivní kontroly, otevřené zkoušky u pacientů s diabetem 2. typu, dříve léčených subkutánním inzulínem (studie G)
| Studie G | Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) |
|---|---|---|
| Velikost vzorku | 146 | 149 |
| UL = humulin® U Ultralente®; SC R = subkutánní normální lidský inzulín | ||
| ||
| HbA1c (%) | ||
| Střední hodnota | 8.1 | 8.2 |
| Adj. průměrná změna oproti základní hodnotě | -0.7 | -0.6 |
| Exubera minus SCR* | -0.07 | |
| 95% CI pro rozdíl v léčbě | (-0.31, 0.17) | |
| Plazmatická glukóza nalačno (mg / dl) | ||
| Střední hodnota | 152 | 159 |
| Adj. průměrná změna oproti základní hodnotě | -22 | -6 |
| Exubera minus SCR | -16.36 | |
| 95% CI pro rozdíl v léčbě | (-27.09, -5.36) | |
| Pacienti s HbA na konci studie1c < 8%†| 76.0% | 69.1% |
| Pacienti s HbA na konci studie1c < 7% | 45.2% | 32.2% |
| Tělesná hmotnost | ||
| Základní průměr (kg) | 90.6 | 89.0 |
| Adj. průměrná změna oproti základní hodnotě (kg) | 0.1 | 1.3 |
| Exubera minus SCR | -1.28 | |
| 95% CI pro rozdíl v léčbě | (-1.96, -0.60) | |
| Na konci studie denní dávka inzulínu | ||
| Krátkodobě působící inzulín | 16,6 mgC | 25,5 IU |
| Dlouhodobě působící inzulín | 37,9 IU | 52,3 IU |
horní
Indikace a použití
Exubera je indikována k léčbě dospělých pacientů s diabetes mellitus pro kontrolu hyperglykémie. Exubera má nástup účinku podobný rychle účinkujícím analogům inzulínu a má trvání aktivity snižující hladinu glukózy srovnatelné s podkožně podávaným běžným lidským inzulínem. U pacientů s diabetem 1. typu by měl být Exubera používán v režimech, které zahrnují déle působící inzulín. U pacientů s diabetem 2. typu může být Exubera použita jako monoterapie nebo v kombinaci s perorálními přípravky nebo inzuliny s dlouhodobým účinkem.
horní
Kontraindikace
Exubera je kontraindikována u pacientů s přecitlivělostí na Exuberu nebo na některou z pomocných látek.
Exubera je kontraindikována u pacientů, kteří kouří nebo kteří přestali kouřit méně než 6 měsíců před zahájením léčby přípravkem Exubera. Pokud pacient začne kouřit nebo začne kouřit, musí být Exubera okamžitě přerušena kvůli zvýšenému riziku hypoglykémie a musí být použita alternativní léčba (viz KLINICKÁ FARMAKOLOGIE, Zvláštní populace, Kouření). Bezpečnost a účinnost přípravku Exubera u pacientů, kteří kouří, nebyla stanovena.
Přípravek Exubera je kontraindikován u pacientů s nestabilním nebo špatně kontrolovaným plicním onemocněním, a to z důvodu velkých variací v plicní funkci, která by mohla ovlivnit vstřebávání Exubery a zvýšit riziko hypoglykémie nebo hyperglykémie.
horní
Varování
Exubera se liší od běžného lidského inzulínu svým rychlým nástupem účinku. Při použití jako inzulín před jídlem by měla být dávka Exubery podána do 10 minut před jídlem.
Hypoglykémie je nejčastěji hlášenou nežádoucí příhodou inzulínové terapie, včetně Exubery. Načasování hypoglykémie se může u různých inzulínových formulací lišit.
Pacienti s diabetem typu 1 také vyžadují dlouhodobě působící inzulín k udržení dostatečné kontroly glukózy.
Jakákoli změna inzulínu by měla být prováděna opatrně a pouze pod lékařským dohledem. Změny v síle inzulínu, výrobce, typu (např. Normální, NPH, analogy) nebo druhu (zvíře, člověk) mohou vést k potřebě změny dávky. Může být nutné upravit souběžnou perorální antidiabetickou léčbu.
Monitorování glukózy se doporučuje všem pacientům s diabetem.
Vzhledem k vlivu přípravku Exubera na plicní funkce by měli být všichni pacienti před zahájením léčby přípravkem Exubera vyhodnoceni plicní funkce (viz bod 4.4). OPATŘENÍ: Plicní funkce).
Použití přípravku Exubera u pacientů se základní plicní chorobou, jako je astma nebo CHOPN, se nedoporučuje, protože bezpečnost a účinnost přípravku Exubera v této populaci nebyla stanovena (viz bod 4.4). OPATŘENÍ: Základní onemocnění plic).
V klinických studiích s přípravkem Exubera se vyskytlo 6 nově diagnostikovaných případů primárních plicních malignit u pacientů léčených Exuberou a 1 nově diagnostikovaný případ mezi pacienty léčenými komparátorem. U pacienta léčeného přípravkem Exubera byla rovněž zaznamenána 1 postmarketingová zpráva o primární malignitě plic. V kontrolovaných klinických studiích s přípravkem Exubera byl výskyt nového primárního karcinomu plic na 100 pacientoroků po dobu expozice léčiva 0,13 (5 případů více než 3900 pacientských let) u pacientů léčených Exuberou a 0,02 (1 případ více než 4100 pacientských let) u pacientů léčených komparátorem. Bylo příliš málo případů, aby bylo možné určit, zda výskyt těchto událostí souvisí s přípravkem Exubera. Všichni pacienti, u kterých byla diagnostikována rakovina plic, měli v anamnéze kouření cigaret.
horní
Opatření
Všeobecné
Stejně jako u všech inzulínových přípravků se časový průběh působení Exubery může lišit u různých jedinců nebo v různých časech u stejného jedince. Úprava dávky jakéhokoli inzulínu může být nezbytná, pokud pacienti změní svou fyzickou aktivitu nebo svůj obvyklý jídelní plán. Požadavky na inzulín mohou být změněny během interkurentních stavů, jako jsou nemoci, emoční poruchy nebo stres.
Hypoglykémie
Stejně jako u všech inzulínových přípravků může být s podáním Exubery spojena hypoglykemická reakce. Rychlé změny koncentrace glukózy v séru mohou u osob s diabetem vyvolat příznaky podobné hypoglykémii, bez ohledu na hodnotu glukózy. Včasné varovné příznaky hypoglykémie se mohou za určitých podmínek, například dlouhé, lišit trvání diabetu, onemocnění diabetických nervů, použití léků, jako jsou beta-blokátory, nebo zesílená kontrola diabetu (vidět OPATŘENÍ: Lékové interakce). Takové situace mohou vést k těžké hypoglykémii (a možná ke ztrátě vědomí) před tím, než si pacient uvědomí hypoglykémii.
Renální postižení
Studie u pacientů s poškozením ledvin nebyly provedeny. Stejně jako u jiných inzulínových přípravků může být u pacientů s poškozením ledvin snížena potřeba dávky přípravku Exubera (viz KLINICKÁ FARMAKOLOGIE, Zvláštní populace).
Jaterní postižení
Studie u pacientů s poškozením jater nebyly provedeny. Stejně jako u jiných inzulínových přípravků může být u pacientů se zhoršenou funkcí jater snížena potřeba dávky přípravku Exubera (viz KLINICKÁ FARMAKOLOGIE, Zvláštní populace).
Alergie
Systémová alergie
V klinických studiích byl celkový výskyt alergických reakcí u pacientů léčených přípravkem Exubera podobný jako u pacientů užívajících subkutánní režimy s běžným lidským inzulínem.
Stejně jako u jiných inzulínových přípravků se může objevit vzácná, ale potenciálně závažná generalizovaná alergie na inzulín, která může způsobit vyrážka (včetně svědění) na celém těle, dušnost, sípání, snížení krevního tlaku, rychlý puls nebo pocení. Závažné případy generalizované alergie, včetně anafylaktických reakcí, mohou být život ohrožující. Pokud k těmto reakcím dojde u Exubery, je třeba Exuberu zastavit a zvážit alternativní terapie.
Produkce protilátek
Během léčby všemi inzulínovými přípravky včetně Exubery se mohou vyvinout inzulínové protilátky. V klinických studiích s přípravkem Exubera, kde byl komparátorem subkutánní inzulín, se zvyšovaly hladiny protilátek proti inzulínu (což se odráží v testech aktivita vázání inzulínu) byla významně vyšší u pacientů, kteří dostávali Exuberu, než u pacientů, kteří dostávali subkutánní inzulín pouze. V průběhu klinických studií s přípravkem Exubera nebyly zjištěny žádné klinické důsledky těchto protilátek; dlouhodobý klinický význam tohoto zvýšení tvorby protilátek však není znám.
Respirační
Plicní funkce
V klinických studiích trvajících až do dvou let se u pacientů léčených přípravkem Exubera projevil větší pokles plicní funkce, konkrétně nucený výdechový objem za jednu sekundu (FEV1) a kapacitu rozptylu oxidu uhelnatého (DLCO), než bylo ošetřeno komparátorem pacientů. Uvnitř byl zaznamenán průměrný rozdíl v léčené skupině v plicní funkci ve prospěch srovnávací skupiny prvních několik týdnů léčby přípravkem Exubera a během dvouletého období léčby se nezměnil (Vidět NEŽÁDOUCÍ REAKCE: Plicní funkce).
Během kontrolovaných klinických studií došlo u jednotlivých pacientů k výraznému poklesu plicní funkce v obou léčebných skupinách. U 1,5% pacientů léčených Exuberou a 1,3% pacientů léčených komparátorem došlo při posledním pozorování k poklesu oproti výchozímu FEV1 o 20% při posledním pozorování. Pokles oproti základní DLCO z 20% při posledním pozorování došlo u 5,1% pacientů léčených Exuberou a 3,6% pacientů léčených komparátorem.
Vzhledem k účinku Exubery na plicní funkci by měli být všichni pacienti před zahájením léčby Exuberou vyšetřeni spirometrií (FEV1). Posouzení DLCO by mělo být zváženo. Účinnost a bezpečnost přípravku Exubera u pacientů s výchozí hodnotou FEV1 nebo DLCO <70% předpovězených nebylo stanoveno a použití přípravku Exubera v této populaci se nedoporučuje.
Vyhodnocení plicní funkce (např. Spirometrie) se doporučuje po prvních 6 měsících léčby a poté každoročně, a to i při absenci plicních příznaků. U pacientů, u kterých došlo k poklesu FEV1 o 20% oproti výchozímu stavu, by se měly opakovat testy plicních funkcí. Pokud je potvrzen pokles â ‰ 20% od výchozí hodnoty FEV1, měla by být Exubera přerušena. Přítomnost plicních příznaků a menší pokles plicních funkcí může vyžadovat častější sledování plicních funkcí a zvážení ukončení léčby přípravkem Exubera.
Základní onemocnění plic
Použití přípravku Exubera u pacientů se základní plicní chorobou, jako je astma nebo CHOPN, se nedoporučuje, protože účinnost a bezpečnost přípravku Exubera v této populaci nebyla stanovena.
Bronchospasmus
U pacientů užívajících Exuberu byl bronchospasmus vzácně hlášen. Pacienti, u kterých dojde k takové reakci, by měli přípravek Exubera přerušit a okamžitě vyhledat lékařské ošetření. Opětovné podání přípravku Exubera vyžaduje pečlivé vyhodnocení rizik a mělo by být prováděno pouze pod pečlivým lékařským dohledem s dostupnými vhodnými klinickými zařízeními.
Interkurentní respirační onemocnění
Exubera byla během klinických studií podávána pacientům s interkurentním onemocněním dýchacích cest (např. Bronchitida, infekce horních cest dýchacích, rýma). U pacientů, u kterých došlo k těmto stavům, 3-4% dočasně přerušilo léčbu přípravkem Exubera. U pacientů léčených Exuberou nebylo ve srovnání s pacienty léčenými subkutánním inzulinem pozorováno zvýšené riziko hypoglykémie nebo zhoršení glykemické kontroly. Během intercurrent respiračního onemocnění může být vyžadováno pečlivé monitorování koncentrací glukózy v krvi a úprava dávky.
Informace pro pacienty
Pacienti by měli být poučeni o postupech samosprávy včetně monitorování glukózy; správná inhalační technika Exubera; a řízení hypoglykémie a hyperglykémie. Pacienti musí být poučeni o řešení zvláštních situací, jako jsou interkurentní stavy (nemoc, stres nebo emoční) poruchy), nepřiměřená nebo vynechaná dávka inzulínu, neúmyslné podání zvýšené dávky inzulínu, nedostatečný příjem potravy nebo vynechaná jídla.
Pacienti by měli být informováni o tom, že v klinických studiích byla léčba přípravkem Exubera spojena s malým, progresivním průměrným poklesem plicní funkce ve srovnání s porovnávacími léčbami. Kvůli účinku Exubery na plicní funkce se před zahájením léčby Exuberou doporučuje vyšetření plicních funkcí. Po zahájení léčby se doporučuje pravidelné testy plicních funkcí (viz OPATŘENÍ Respirační, plicní funkce).
Pacienti by měli informovat svého lékaře, pokud mají v anamnéze plicní onemocnění, protože použití přípravku Exubera se v roce 2006 nedoporučuje pacienti se základním plicním onemocněním (např. astma nebo CHOPN) a je kontraindikováno u pacientů se špatně kontrolovanými plicemi choroba.
Ženy s diabetem by měly být informovány, aby informovaly svého lékaře, pokud jsou těhotné nebo uvažují o těhotenství.
horní
Lékové interakce
Řada látek ovlivňuje metabolismus glukózy a může vyžadovat úpravu dávky inzulínu a zvláště pečlivé sledování.
Níže uvádíme příklady látek, které mohou snižovat účinek inzulínu na snižování hladiny glukózy v krvi, který může vést k hyperglykémii: kortikosteroidy, danazol, diazoxid, diuretika, sympatomimetika (např. epinefrin, albuterol, terbutalin), glukagon, isoniazid, fenothiazinové deriváty, somatropin, hormony štítné žlázy, estrogeny, progestogeny (např. v perorální antikoncepci), inhibitory proteázy a atypická antipsychotika (např. olanzapin a clozapin).
Níže jsou uvedeny příklady látek, které mohou zvýšit účinek inzulínu na snížení hladiny glukózy v krvi a náchylnost k hypoglykémii: orální antidiabetické přípravky, ACE inhibitory, disopyramid, fibráty, fluoxetin, inhibitory MAO, pentoxifylin, propoxyfen, salicyláty a sulfonamid antibiotika.
Beta-blokátory, klonidin, lithné soli a alkohol mohou zvýšit nebo snížit účinek inzulínu na snížení hladiny glukózy v krvi. Pentamidin může způsobit hypoglykémii, po které může někdy následovat hyperglykémie.
Kromě toho mohou být pod vlivem sympatolytických léčivých přípravků, jako jsou beta-blokátory, klonidin, guanethidin a reserpin, známky nebo příznaky hypoglykémie sníženy nebo chybí.
Absorpce inhalovaného lidského inzulínu může změnit bronchodilatancia a další inhalační přípravky (viz KLINICKÁ FARMAKOLOGIE, Zvláštní populace). Doporučuje se důsledné načasování podávání bronchodilatátorů vzhledem k podávání Exubery, pečlivé monitorování koncentrací glukózy v krvi a případně titrace dávky.
Karcinogeneze, mutageneze, zhoršení plodnosti
Dvouleté studie karcinogenity u zvířat nebyly provedeny. Inzulin nebyl mutagenní v testu bakteriální reverzní mutace Ames v přítomnosti a nepřítomnosti metabolické aktivace.
U potkanů Sprague-Dawley byla provedena šestiměsíční studie toxicity po opakovaném podání s inhalačním práškem inzulínu v dávkách až 5,8 mg / kg / den (ve srovnání s klinickými počáteční dávka 0,15 mg / kg / den byla vysoká dávka krysy 39krát nebo 8,3krát vyšší než klinická dávka, vztaženo buď na srovnání plochy povrchu těla v mg / kg nebo mg / m2). U opic Cynomolgus byla prováděna šestiměsíční studie toxicity po opakovaném podání inhalačního inzulínu v dávkách až 0,64 mg / kg / den. Ve srovnání s klinickou počáteční dávkou 0,15 mg / kg / den byla vysoká dávka opice 4,3krát nebo 1,4krát vyšší než klinická dávka, a to na základě srovnání buď plochy povrchu těla mg / kg nebo mg / m2. Jednalo se o maximální tolerované dávky založené na hypoglykémii.
Ve srovnání s kontrolními zvířaty nebyly pozorovány žádné nežádoucí účinky související s léčbou u jakýchkoli druhů na plicní funkci, hrubou nebo mikroskopickou morfologii dýchacích cest nebo bronchiálních lymfatických uzlin. Podobně nebyl žádný účinek na indexy buněčné proliferace v alveolární nebo bronchiolarní oblasti plic u žádného druhu.
Vzhledem k tomu, že rekombinantní lidský inzulín je identický s endogenním hormonem, nebyly na zvířatech provedeny reprodukční / fertilitní studie.
Těhotenství
Teratogenní účinky
Kategorie těhotenství C
Studie reprodukce na zvířatech nebyly s přípravkem Exubera provedeny. Není také známo, zda může Exubera způsobit poškození plodu při podání těhotné ženě, nebo zda může Exubera ovlivnit reprodukční kapacitu. Exubera by měla být podávána těhotné ženě, pouze pokud je to nezbytně nutné.
Kojící matky
Mnoho léků, včetně lidského inzulínu, se vylučuje do mateřského mléka. Z tohoto důvodu je třeba při podávání Exubery kojící ženě postupovat opatrně. Pacienti s diabetem, kteří kojí, mohou vyžadovat úpravu dávky přípravku Exubera, stravovacího plánu nebo obojího.
Pediatrické použití
Dlouhodobá bezpečnost a účinnost přípravku Exubera u pediatrických pacientů nebyla stanovena (viz KLINICKÁ FARMAKOLOGIE, Zvláštní populace).
Geriatrické použití
V kontrolovaných klinických studiích fáze 2/3 (n = 1975) byl přípravek Exubera podáván 266 pacientům ve věku 65 let a 30 pacientům ve věku 75 let. Většina z těchto pacientů měla diabetes 2. typu. Změna HbA1C a rychlost hypoglykémie se nelišila podle věku.
horní
Nežádoucí reakce
Bezpečnost Exubery samotné nebo v kombinaci se subkutánním inzulinem nebo perorálními přípravky byla vysoká hodnoceno přibližně u 2 500 dospělých pacientů s diabetem 1. nebo 2. typu, kteří byli vystaveni Exubera. Přibližně 2000 pacientů bylo vystaveno Exubere déle než 6 měsíců a více než 800 pacientů bylo vystaveno déle než 2 roky.
Nespirační nežádoucí účinky
Non-respirační nežádoucí účinky hlášené u 1% z 1977 pacientů léčených Exubera v kontrolovaných klinických studiích fáze 2/3, bez ohledu na příčinnou souvislost, zahrnují (ale nejsou omezeny na) následující:
Metabolické a nutriční: hypoglykémie (viz VAROVÁNÍ a OPATŘENÍ)
Tělo jako celek: bolest na hrudi
Trávicí soustava: sucho v ústech
Speciální smysly: zánět středního ucha (dětští diabetici 1. typu)
Hypoglykémie
Míra a incidence hypoglykémie byla srovnatelná mezi Exuberou a subkutánním běžným lidským inzulínem u pacientů s diabetem 1. a 2. typu. U pacientů typu 2, kteří nebyli adekvátně kontrolováni terapií jednou perorální látkou, přidání Exubera byla spojena s vyšší mírou hypoglykémie, než tomu bylo při přidání druhého orální činidlo.
Bolest na hrudi
Jako nežádoucí účinky byly hlášeny různé příznaky hrudníku a byly seskupeny do nespecifického termínu bolest na hrudi. Tyto příhody se vyskytly u 4,7% pacientů léčených přípravkem Exubera a 3,2% pacientů ve srovnávacích skupinách. Většina (> 90%) těchto událostí byla hlášena jako mírná nebo střední. Dva pacienti ve skupině Exubera a jeden ve srovnávací skupině přerušili léčbu z důvodu bolesti na hrudi. Výskyt všech příčinných souvislostí souvisejících s onemocněním koronárních tepen, jako je angina pectoris nebo infarkt myokardu, byl srovnatelný u Exubery (0,7% angina pectoris; 0,7% infarkt myokardu) a komparátor (1,3% angina pectoris; 0,7% infarktu myokardu).
Suchá ústa
Sucho v ústech bylo hlášeno u 2,4% pacientů léčených Exuberou a 0,8% pacientů ve srovnávacích skupinách. Téměř všechny (> 98%) hlášené sucho v ústech byly mírné nebo střední. Žádný pacient neskončil léčbu v důsledku sucha v ústech.
Ušní události u dětské diabetiky
Pediatričtí diabetici 1. typu ve skupinách Exubera zaznamenali nežádoucí účinky související s uchem častěji než pediatričtí diabetici 1. typu v léčených skupinách, kteří dostávali pouze subkutánní inzulín. Tyto události zahrnovaly otitis media (Exubera 6,5%; SC 3,4%), bolest ucha (Exubera 3,9%; SC 1,4%) a porucha ucha (Exubera 1,3%; SC 0%).
Respirační nežádoucí účinky
Tabulka 6 ukazuje výskyt respiračních nežádoucích účinků pro každou hlášenou léčebnou skupinu v â ‰ ¥ 1% jakékoli léčebné skupiny v kontrolovaných klinických studiích fáze 2 a 3, bez ohledu na příčinnou souvislost.
Tabulka 6: Respirační nežádoucí účinky hlášené v 1% jakékoli léčebné skupiny v kontrolovaných fázích 2 a 3 klinických studií, bez ohledu na kauzalitu
| Procento událostí hlášení pacientů | |||||
|---|---|---|---|---|---|
| Nepříznivá událost | Diabetes 1. typu | Diabetes typu 2 | |||
| Exubera N = 698 |
SC N = 705 |
Exubera N = 1279 |
SC N = 488 |
OAs N = 644 |
|
| SC = subkutánní inzulinový komparátor; OA = komparátory perorálních látek | |||||
| Infekce dýchacích cest | 43.3 | 42.0 | 29.2 | 38.1 | 19.7 |
| Kašel se zvýšil | 29.5 | 8.8 | 21.9 | 10.2 | 3.7 |
| Zánět hltanu | 18.2 | 16.6 | 9.5 | 9.6 | 5.9 |
| Rýma | 14.5 | 10.9 | 8.8 | 10.5 | 3.0 |
| Sinusitida | 10.3 | 7.4 | 5.4 | 10.0 | 2.3 |
| Respirační porucha | 7.4 | 4.1 | 6.1 | 10.2 | 1.7 |
| Dušnost | 4.4 | 0.9 | 3.6 | 2.5 | 1.4 |
| Sputum zvýšeno | 3.9 | 1.3 | 2.8 | 1.0 | 0.5 |
| Bronchitida | 3.2 | 4.1 | 5.4 | 3.9 | 4.0 |
| Astma | 1.3 | 1.3 | 2.0 | 2.3 | 0.5 |
| Epistaxe | 1.3 | 0.4 | 1.2 | 0.4 | 0.8 |
| Zánět hrtanu | 1.1 | 0.4 | 0.5 | 0.4 | 0.3 |
| Zápal plic | 0.9 | 1.1 | 0.9 | 1.6 | 0.6 |
| Hlasová úprava | 0.1 | 0.1 | 1.3 | 0.0 | 0.3 |
Kašel
Ve 3 klinických studiích pacienti, kteří vyplnili dotazník proti kašlu, uvedli, že kašel se uvnitř vyskytoval vteřiny až minuty po inhalaci Exubera, byla převážně mírná a v zřídka produktivní Příroda. Výskyt tohoto kašle klesal s pokračujícím používáním Exubery. V kontrolovaných klinických studiích 1,2% pacientů přerušilo léčbu přípravkem Exubera v důsledku kašle.
Dušnost
Téměř veškerá (> 97%) dušnost byla hlášena jako mírná nebo střední. Malý počet pacientů léčených přípravkem Exubera (0,4%) přerušil léčbu kvůli dušnosti ve srovnání s 0,1% pacientů léčených komparátorem.
Jiné respirační nežádoucí účinky - faryngitida, zvýšené sputum a epistaxa
Většina těchto událostí byla hlášena jako mírná nebo střední. Malý počet pacientů léčených přípravkem Exubera přerušil léčbu kvůli faryngitidě (0,2%) a zvýšení sputa (0,1%); žádný pacient nepřerušil léčbu z důvodu epistaxe.
Plicní funkce
Účinek přípravku Exubera na dýchací systém byl hodnocen u více než 3800 pacientů v kontrolovaných klinických studiích fáze 2 a 3 (v nichž bylo 1977 pacientů léčeno přípravkem Exubera). V randomizovaných otevřených klinických studiích trvajících až do dvou let byli pacienti léčeni přípravkem Exubera prokázali větší pokles plicní funkce, konkrétně nuceného výdechového objemu v jednom sekunda (FEV1) a kapacitu rozptylu oxidu uhelnatého (DLCO), než u pacientů léčených komparátorem. Průměrné rozdíly v léčebné skupině u FEV1 a DLCO, byly zaznamenány během prvních několika týdnů léčby přípravkem Exubera a během dvouletého období léčby nepostupovaly. V jedné dokončené kontrolované klinické studii u pacientů s diabetem typu 2 po dvou letech léčby přípravkem Exubera prokázali pacienti rozlišení rozdílu v léčebné skupině u FEV1 šest týdnů po přerušení léčby. Rozlišení účinku Exubery na plicní funkce u pacientů s diabetem typu 1 nebylo po dlouhodobé léčbě studováno.
Obrázky 3 až 6 znázorňují střední FEV1 a DLCO změna oproti výchozímu stavu oproti času ze dvou probíhajících randomizovaných, otevřených, dvouletých studií na 580 pacientech s diabetem typu 1 a 620 pacientů s diabetem typu 2.
Obrázek 3: Změna z výchozí hodnoty FEV1 (L) u pacientů s diabetem 1. typu (průměrná +/- směrodatná odchylka)
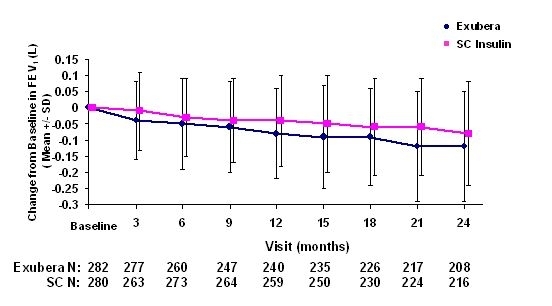
Obrázek 4: Změna z výchozí hodnoty FEV1 (L) u pacientů s diabetem 2. typu (průměrná +/- směrodatná odchylka)
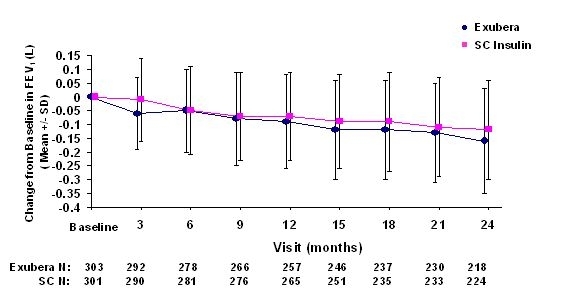
Po 2 letech léčby přípravkem Exubera u pacientů s diabetem 1. a 2. typu je rozdíl mezi léčenými skupinami byla průměrná změna od výchozí hodnoty FEV1 přibližně 40 ml, což bylo výhodné komparátor.
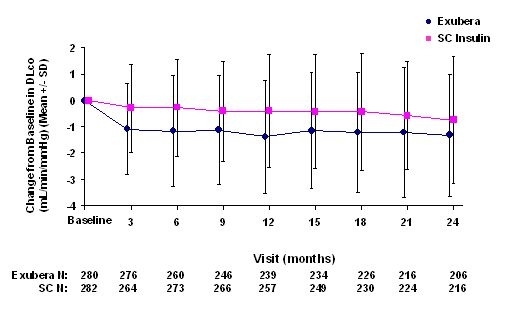
Obrázek 5: Změna ze základní DLco (mL / min / mmHg) u pacientů s diabetem 1. typu (průměrná +/- směrodatná odchylka)
Obrázek 6: Změna ze základní DLco (mL / min / mmHg) u pacientů s diabetem 2. typu (průměrná +/- směrodatná odchylka)
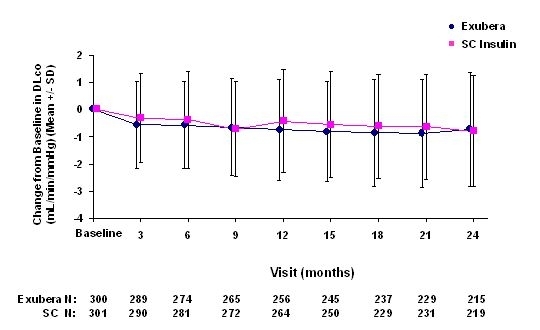
Po 2 letech léčby přípravkem Exubera byl rozdíl mezi léčenými skupinami o průměrné změně oproti základní DLCO byl přibližně 0,5 ml / min / mmHg (diabetes typu 1), výhoda komparátoru, a přibližně 0,1 ml / min / mmHg (diabetes typu 2), výhoda Exubera.
Během dvouletých klinických studií došlo u jednotlivých pacientů k výraznému poklesu plicní funkce v obou léčebných skupinách. Pokles od výchozí hodnoty FEV1 z 20% při posledním pozorování došlo u 1,5% pacientů léčených Exuberou a 1,3% pacientů léčených komparátorem. Pokles oproti základní DLCO z 20% při posledním pozorování došlo u 5,1% pacientů léčených Exuberou a 3,6% pacientů léčených komparátorem.
horní
Předávkování
Hypoglykémie se může objevit v důsledku nadměrného množství inzulínu vzhledem k příjmu potravy, výdaji energie nebo obojí.
Mírné až střední epizody hypoglykémie lze obvykle léčit perorální glukózou. Může být nutné upravit dávkování léků, stravovací návyky nebo cvičení.
Těžké epizody hypoglykémie s kómatem, záchvaty nebo neurologickým poškozením mohou být léčeny intramuskulárním / subkutánním glukagonem nebo koncentrovanou intravenózní glukózou. Po zjevném klinickém zotavení může být nutný trvalý příjem uhlohydrátů a jejich sledování, protože hypoglykémie se může opakovat.
horní
Dávkování a správa
Exubera, stejně jako rychle působící analogy inzulínu, má rychlejší nástup aktivity snižující hladinu glukózy ve srovnání se subkutánně injikovaným běžným lidským inzulínem. Exubera má trvání aktivity snižující hladinu glukózy srovnatelné s podkožně injikovaným běžným lidským inzulínem a delší než rychle působící inzulín. Dávky Exubery by měly být podávány bezprostředně před jídlem (ne více než 10 minut před každým jídlem).
U pacientů s diabetem 1. typu by měl být Exubera používán v režimech, které zahrnují déle působící inzulín. U pacientů s diabetem 2. typu může být Exubera použita jako monoterapie nebo v kombinaci s perorálními přípravky nebo dlouhodobě působícím inzulínem.
Vzhledem k účinku přípravku Exubera na plicní funkci by měli být všichni pacienti před zahájením léčby přípravkem Exubera vyšetřeni na plicní funkci. U pacientů léčených přípravkem Exubera se doporučuje pravidelné sledování plicních funkcí (viz OPATŘENÍ, Plicní funkce).
Exubera je určena k podávání inhalací a musí být podávána pouze pomocí Exubery® Inhalátor. Odkazovat na Exubera Medication Guide popis Exubery® Inhalátor a pokyny k použití inhalátoru.
Výpočet počáteční dávky Exubera před jídlem
Počáteční dávka Exubery by měla být individualizována a stanovena na základě doporučení lékaře v souladu s potřebami pacienta. Doporučené počáteční dávky před jídlem jsou založeny na klinických studiích, ve kterých byli pacienti požádáni, aby jedli tři jídla denně. Počáteční dávky před jídlem lze vypočítat podle následujícího vzorce: [tělesná hmotnost (kg) X 0,05 mg / kg = dávka před jídlem (mg)] zaokrouhleno dolů na nejbližší celé miligramové číslo (např. 3,7 mg zaokrouhleno dolů na 3 mg).
Přibližné pokyny pro počáteční dávky přípravku Exubera před jídlem, založené na tělesné hmotnosti pacienta, jsou uvedeny v tabulce 7:
Tabulka 7: Přibližné pokyny pro počáteční dávku Exubera před jídlem (na základě tělesné hmotnosti pacienta)
| Hmotnost pacienta (v kg) |
Hmotnost pacienta (v librách) |
Počáteční dávka na jídlo | Počet 1 mg blistrů na dávku | Počet 3 mg blistrů na dávku |
|---|---|---|---|---|
| 30 až 39,9 kg | 66 - 87 liber | 1 mg na jedno jídlo | 1 | - |
| 40 až 59,9 kg | 88 - 132 liber | 2 mg na jedno jídlo | 2 | - |
| 60 až 79,9 kg | 133 - 176 liber | 3 mg na jedno jídlo | - | 1 |
| 80 až 99,9 kg | 177 - 220 liber | 4 mg na jedno jídlo | 1 | 1 |
| 100 až 119,9 kg | 221 - 264 liber | 5 mg na jedno jídlo | 2 | 1 |
| 120 až 139,9 kg | 265 - 308 liber | 6 mg na jídlo | - | 2 |
Blistr 1 mg Exubera inhalovaného inzulínu je přibližně ekvivalentní 3 IU subkutánně injikovaného normálního lidského inzulínu. Blistr 3 mg Exubery inhalovaného inzulínu je přibližně ekvivalentní 8 IU subkutánně injikovaného normálního lidského inzulínu. Tabulka 8 uvádí přibližnou IU dávku pravidelného subkutánního lidského inzulínu pro inhalační dávky inzulínu Exubera od 1 mg do 6 mg.
Tabulka 8: Přibližná ekvivalentní dávka IU pravidelného lidského subkutánního inzulínu pro inhalační dávky inzulínu Exubera v rozmezí od 1 mg do 6 mg
| Dávka (mg) | Přibližná pravidelná dávka inzulínu SC v IU | Počet 1 mg blistrů Exubera na dávku | Počet 3 mg blistrů Exubera na dávku |
|---|---|---|---|
| 1 mg | 3 | 1 | - |
| 2 mg | 6 | 2 | - |
| 3 mg | 8 | - | 1 |
| 4 mg | 11 | 1 | 1 |
| 5 mg | 14 | 2 | 1 |
| 6 mg | 16 | - | 2 |
Pacienti by měli kombinovat 1 mg a 3 mg blistry tak, aby byl užit co nejmenší počet blistrů na dávku (např. Dávka 4 mg by měla být podávána jako jeden blistr 1 mg a jeden blistr 3 mg). Následná inhalace tří blistrů s jednotkovou dávkou 1 mg má za následek výrazně vyšší expozici inzulínu než inhalace jednoho blistru s jednotkovou dávkou 3 mg. Tři dávky 1 mg by proto neměly být nahrazeny jednou dávkou 3 mg (viz KLINICKÁ FARMAKOLOGIE, Farmakokinetika). Když je pacient stabilizován v dávkovacím režimu, který obsahuje 3 mg blistry a 3 mg blistry Pokud se stane dočasně nedostupnou, může pacient dočasně nahradit dva 3 mg blistry za 3 mg puchýř. Hladinu glukózy v krvi je třeba pečlivě sledovat.
Stejně jako u všech inzulínů je třeba při stanovení počáteční dávky přípravku Exubera vzít v úvahu i další faktory nejsou omezeny na současnou glykemickou kontrolu pacienta, předchozí odpověď na inzulín, trvání diabetu a dietu a cvičení zvyky.
Úvahy o titraci dávky
Po zahájení léčby přípravkem Exubera, stejně jako u jiných látek snižujících hladinu glukózy, může být nutné upravit dávku na základě potřeby pacienta (např. koncentrace glukózy v krvi, velikost jídla a složení živin, denní doba a nedávná nebo očekávaná) cvičení). Každý pacient by měl být titrován na optimální dávku na základě výsledků monitorování hladiny glukózy v krvi.
Jako u všech inzulínů, časový průběh působení Exubery se může lišit u různých jedinců nebo v různých časech u stejného jednotlivce.
Exubera může být použita při interkurentním respiračním onemocnění (např. Bronchitida, infekce horních cest dýchacích, rýma). Může být vyžadováno pečlivé sledování koncentrací glukózy v krvi a úprava dávky na individuálním základě. Inhalační léčivé přípravky (např. Bronchodilatátory) by měly být podávány před podáním Exubery.
horní
Jak dodáván
Exubera (lidský inzulín [původ rDNA]) Inhalační prášek je k dispozici v 1 mg a 3 mg blistrech s jednotkovou dávkou. Blistry jsou vydávány na perforovaných kartičkách se šesti blistry s jednotkovou dávkou (PVC / hliník). Obě silné stránky jsou rozlišeny barevným potiskem a hmatovými značkami, které lze rozlišit dotykem. 1 mg blistry a příslušné perforované karty jsou potištěny zeleným inkoustem a karty jsou označeny jednou zvýšenou čarou. 3 mg blistry a příslušné perforované karty jsou potištěny modrým inkoustem a karty jsou označeny třemi vyvýšenými pruhy.
Pět blistrových karet je baleno v čirém plastovém (PET) termoformovaném zásobníku. Každý podnos PET také obsahuje sušicí prostředek a je potažen čirým plastovým víčkem (PET). Podnos s pěti blistry (blistry s 30 jednotkovými dávkami) je utěsněn ve fóliovém laminátovém sáčku s vysoušedlem.
Exubera (lidský inzulín [původ rDNA]) Inhalační pudrové puchýře, Exubera® Inhalátor a náhradní Exubera® Pro zahájení léčby přípravkem Exubera jsou vyžadovány uvolňovací jednotky a jsou součástí soupravy Exubera. Plně sestavená Exubera® Inhalátor se skládá ze základny inhalátoru, komory a Exubery® Uvolněte jednotku. Plně sestavený inhalátor je balen s náhradní komorou a je k dispozici v sadě Exubera a jako samostatná jednotka. Komora je k dispozici také jako samostatná složka.
Exubera® Uvolňovací jednotky jsou jednotlivě baleny v utěsněném termoformovaném zásobníku. Jedna Exubera® Uvolňovací jednotka je součástí každého plně sestaveného inhalátoru. V soupravě Exubera a v každém kombinovaném balení jsou k dispozici dvě další uvolňovací jednotky. Vydávací jednotky Exubera jsou k dispozici také jednotlivě.
Popis těchto konfigurací najdete v tabulkách 9 a 10.
Tabulka 9
| Exubera (lidský inzulín [původ rDNA]) Inhalační prášek je k dispozici takto: | ||
|---|---|---|
| Popis | Obsah | NDC |
| Exubera KIT | 1 Exubera Inhaler 1 Náhradní komora 1 mg 180 180 blistrů 3 mg - 90 blistrů 2 Exubera® Uvolněte jednotky |
0069-0050-85 |
| Kombinovaný balíček Exubera 12 | 1 mg œ 90 blistrů 3 mg - 90 blistrů 2 Exubera® Uvolněte jednotky |
0069-0050-19 |
| Kombinovaná balení Exubera 15 | 1 mg 180 180 blistrů 3 mg - 90 blistrů 2 Exubera® Uvolněte jednotky |
0069-0050-53 |
| Balení pro pacienta Exubera 1 mg | 90 × 1 mg 2 Exubera® Uvolněte jednotky |
0069-0707-37 |
| Balení pro pacienty Exubera 3 mg | 90 × 3 mg 2 Exubera® Uvolněte jednotky |
0069-0724-37 |
Tabulka 10
| Exubera® Inhalátor a komponenty jsou k dispozici takto: | ||
|---|---|---|
| Popis | Obsah | NDC |
| Exubera® Inhaler a komora | 1 Exubera® Inhalátor 1 Náhradní komora |
0069-0054-19 |
| Exubera® Uvolněte jednotky | 2 Exubera® Uvolněte jednotky | 0069-0097-41 |
| Exubera® Komora | 1 Náhradní komora | 0069-0061-19 |
Skladování blistrů
Nepoužívá se (neotevřené): Uchovávejte při kontrolované pokojové teplotě, 25 ° C (77 ° F); dovolené odchylky od 15 do 30 ° C (viz USP regulovaná pokojová teplota). Chraňte před mrazem. Chraňte před chladem.
Používané: Jakmile je přebal fólie otevřen, puchýře s jednotkovou dávkou by měly být chráněny před vlhkostí a skladovány při 25 ° C (77 ° F); dovolené odchylky od 15 do 30 ° C (viz USP regulovaná pokojová teplota). Chraňte před mrazem. Chraňte před chladem. Blistry s jednotkovou dávkou by měly být použity do 3 měsíců po otevření přebalu fólie. Vraťte puchýře do přebalu, aby byl chráněn před vlhkostí. Je třeba věnovat zvýšenou pozornost tomu, aby se zabránilo vlhkým prostředím, např. zapařená koupelna po sprše.
Zlikvidujte blistr, pokud je zmrazený.
Inhalační skladování
Skladujte při kontrolované pokojové teplotě, 25 ° C (77 ° F); dovolené odchylky od 15 do 30 ° C (viz USP regulovaná pokojová teplota). Chraňte před mrazem. Chraňte před chladem.
Exubera® Inhalátor lze používat až 1 rok od data prvního použití.
Výměna zařízení Exubera® Uvolněte jednotku
Exubera® Uvolněte jednotku v Exubere® Inhalátor by měl být měněn každé 2 týdny.
Uchovávejte mimo dosah dětí
Pouze Rx

LAB-0331-12.0
poslední revize 04/2008
Exubera, lidský inzulín [původ rDNA] Informace o pacientovi (v prosté angličtině)
Podrobné informace o příznacích, příznacích, příčinách, léčbě cukrovky
Účelem informací v této monografii není pokrýt všechna možná použití, pokyny, preventivní opatření, lékové interakce nebo nepříznivé účinky. Tyto informace jsou zobecněné a neslouží jako zvláštní lékařská pomoc. Pokud máte dotazy týkající se léčivých přípravků, které užíváte, nebo byste chtěli získat více informací, obraťte se na svého lékaře, lékárníka nebo zdravotní sestru.
zpět k: Procházet všechny léky na cukrovku


