Prandin pro léčbu cukrovky
Název značky: Prandin
Obecný název: repaglinid
Obsah:
Popis
Farmakologie
Indikace a použití
Kontraindikace
Opatření
Nežádoucí reakce
Předávkovat
Dávkování
Dodáván
Prandin, informace o pacientech (v prosté angličtině)
Popis
Prandin® (repaglinid) je orální lék snižující hladinu glukózy v krvi třídy meglitinidů používaný v léčba diabetes mellitus 2. typu (také známý jako diabetes mellitus nezávislý na inzulínu nebo NIDDM). Kyselina repaglinid, kyselina S (+) 2-ethoxy-4 (2 ((3-methyl-1- (2- (1-piperidinyl) fenyl) -butyl) amino) -2-oxoethyl) benzoová), chemicky nesouvisí s orální) sekretagogy sulfonylmočovinového inzulínu.
Strukturální vzorec je uveden níže:
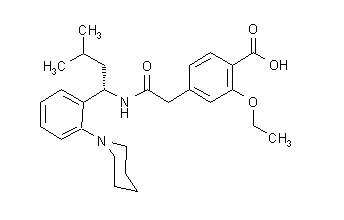
Repaglinid je bílý až téměř bílý prášek s molekulárním vzorcem C27H36N204 a molekulovou hmotností 452,6. Tablety Prandin obsahují 0,5 mg, 1 mg nebo 2 mg repaglinidu. Každá tableta navíc obsahuje následující neaktivní složky: hydrogenfosforečnan vápenatý (bezvodý), mikrokrystalická celulóza, kukuřičný škrob, draselný polacrilin, povidon, glycerol (85%), stearát hořečnatý, meglumin, a poloxamer. Tablety s obsahem 1 mg a 2 mg obsahují jako barviva oxidy železa (žluté, respektive červené).
horní
Klinická farmakologie
Mechanismus účinku
Repaglinid snižuje hladinu glukózy v krvi stimulací uvolňování inzulínu z pankreatu. Tato akce je závislá na fungování beta (Ÿ) buněk v pankreatických ostrůvcích. Uvolňování inzulínu je závislé na glukóze a snižuje se při nízkých koncentracích glukózy.
Repaglinid uzavírá ATP-dependentní draslíkové kanály v membráně cell buněk vazbou na charakteristických místech. Tato blokáda draslíkových kanálů depolarizuje Ÿ-buňku, což vede k otevření vápníkových kanálů. Výsledný zvýšený přítok vápníku indukuje sekreci inzulínu. Mechanismus iontového kanálu je vysoce tkáňově selektivní s nízkou afinitou pro srdeční a kosterní sval.
Farmakokinetika
Vstřebávání:
Po perorálním podání se repaglinid rychle a úplně vstřebává z gastrointestinálního traktu. Po jednorázové a opakované perorální dávce u zdravých osob nebo pacientů se maximální plazmatické hladiny léku (Cmax) objeví během 1 hodiny (Tmax). Repaglinid je rychle vylučován z krevního oběhu s poločasem přibližně 1 hodiny. Průměrná absolutní biologická dostupnost je 56%. Když byl repaglinid podáván s jídlem, průměrná Tmax se nezměnila, ale průměrná Cmax a AUC (plocha pod křivkou závislosti koncentrace na čase / plazmě) byla snížena o 20%, respektive o 12,4%.
Rozdělení:
Po intravenózním (IV) dávkování u zdravých jedinců byl distribuční objem v ustáleném stavu (Vss) 31 l a celková tělesná clearance (CL) byla 38 l / h. Vazba na proteiny a vazba na lidský sérový albumin byla vyšší než 98%.
Metabolismus:
Repaglinid je zcela metabolizován oxidační biotransformací a přímou konjugací s glukuronovou kyselinou po intravenózní nebo perorální dávce. Hlavními metabolity jsou oxidovaná dikarboxylová kyselina (M2), aromatický amin (M1) a acylglukuronid (M7). Bylo prokázáno, že enzymový systém cytochromu P-450, konkrétně 2C8 a 3A4, se účastní N-dealkylace repaglinidu na M2 a další oxidace na M1. Metabolity nepřispívají k hypoglykemickému účinku repaglinidu.
Vylučování:
Během 96 hodin po podání 14C-repaglinidu v jedné orální dávce bylo přibližně 90% radioaktivního značení získáno ve stolici a přibližně 8% v moči. Pouze 0,1% dávky se vylučuje močí jako výchozí látka. Hlavní metabolit (M2) představoval 60% podané dávky. Ve stolici bylo získáno méně než 2% mateřské drogy.
Farmakokinetické parametry:
Farmakokinetické parametry repaglinidu získané z jednorázové zkřížené studie u zdravých jedinců az a studie vícedávkové, paralelní, úměrné dávce (0,5, 1, 2 a 4 mg) u pacientů s diabetem 2. typu jsou shrnuty v následující tabulka:
| Parametr | Pacienti s diabetem 2. typu * |
|
Dávka 0,5 mg 1 mg 2 mg 4 mg |
AUC0-24 hodin Průměr ± SD (ng / ml * h): 68.9 ± 154.4 125.8 ± 129.8 152.4 ± 89.6 447.4 ± 211.3 |
|
Dávka 0,5 mg 1 mg 2 mg 4 mg |
Cmax0-5 hodin Průměr ± SD (ng / ml): 9.8 ± 10.2 18.3 ± 9.1 26.0 ± 13.0 65.8 ± 30.1 |
|
Dávka 0,5 - 4 mg |
Tmax0-5 hodin Prostředky (SD) 1,0 - 1,4 (0,3 - 0,5) h |
|
Dávka 0,5 - 4 mg |
T ½ Prostředky (Ind Range) 1,0 - 1,4 (0,4 - 8,0) h |
| Parametr | Zdravé subjekty |
| CL na základě i.v. | 38 ± 16 l / h |
| PROTIss na základě i.v. | 31 ± 12 l |
| AbsBio | 56 ± 9% |
|
CL = celková tělesná vůle PROTIss= distribuční objem v ustáleném stavu AbsBio = absolutní biologická dostupnost |
* dávkování preprandially se třemi jídly
Tato data ukazují, že repaglinid se v séru nehromadil. Klírens perorálního repaglinidu se v rozmezí dávek 0,5 - 4 mg nezměnil, což naznačuje lineární vztah mezi dávkou a hladinou léčiva v plazmě.
Variabilnost expozice:
AUC repaglinidu po opakovaných dávkách 0,25 až 4 mg s každým jídlem kolísá v širokém rozmezí. Variační koeficienty v rámci jednotlivce byly 36%, respektive 69%. AUC v rozmezí terapeutických dávek zahrnovalo 69 až 1005 ng / ml * h, ale expozice AUC až 5417 ng / ml * h byla dosažena ve studiích zvyšování dávky bez zjevných nepříznivých důsledků.
Zvláštní populace:
Geriatrická:
Zdraví dobrovolníci byli léčeni režimem 2 mg užívaným před každým ze 3 jídel. Mezi skupinami pacientů nebyly žádné významné rozdíly ve farmakokinetice repaglinidu PRECAUTIONS, Geriatric Use)
Pediatric:
U pediatrických pacientů nebyly provedeny žádné studie.
Rod:
Srovnání farmakokinetiky u mužů a žen ukázalo, že AUC v rozmezí dávek 0,5 mg až 4 mg byla o 15% až 70% vyšší u žen s diabetem typu 2. Tento rozdíl se neodráží ve frekvenci hypoglykemických epizod (muž: 16%; žena: 17%) nebo jiné nežádoucí účinky. S ohledem na pohlaví není indikována žádná změna v obecném doporučení pro dávkování, protože dávkování pro každého pacienta by mělo být individualizováno, aby se dosáhlo optimální klinické odpovědi.
Závod:
Nebyly provedeny žádné farmakokinetické studie k posouzení účinků rasy, ale v americké jednoleté studii u pacientů s u diabetu 2. typu byl účinek na snížení hladiny glukózy v krvi srovnatelný u Kavkazanů (n = 297) a Afroameričanů (n = 33). V americké studii závislosti odpovědi na dávce nebyl patrný žádný rozdíl v expozici (AUC) mezi bělochy (n = 74) a hispánci (n = 33).
Lékové interakce
Studie lékových interakcí provedené u zdravých dobrovolníků ukazují, že Prandin neměl klinicky relevantní účinek na farmakokinetické vlastnosti digoxinu, theofylinu nebo warfarinu. Současné podávání cimetidinu s Prandinem významně nezměnilo absorpci a dispozici repaglinidu.
Kromě toho byla následující léčiva studována u zdravých dobrovolníků se současným podáváním Prandinu. Níže jsou uvedeny výsledky:
Gemfibrozil a itrakonazol:
Souběžné podávání gemfibrozilu (600 mg) a jedné dávky 0,25 mg Prandinu (po 3 dnech 600 mg dvakrát denně) gemfibrozil) vedl k 8,1násobně vyšší AUC repaglinidu a prodlouženému poločasu repaglinidu od 1,3 do 3,7 hodiny. Souběžné podávání s itrakonazolem a jednorázovou dávkou 0,25 mg Prandinu (třetí den a režim počáteční dávky 200 mg, 100 mg itrakonazolu dvakrát denně) vedl k 1,4násobnému zvýšení repaglinid AUC. Souběžné podávání gemfibrozilu a itrakonazolu s Prandinem vedlo k 19násobně vyšší AUC repaglinidu a prodlouženému poločasu repaglinidu na 6,1 hodiny. Koncentrace repaglinidu v plazmě po 7 hodinách vzrostla při souběžném podávání gemfibrozilu 28,6krát a při kombinaci gemfibrozil-itrakonazol 70,4krát (viz viz. OPATŘENÍ, Drug-Drug Interactions).
Ketokonazol:
Souběžné podání 200 mg ketokonazolu a jedné dávky 2 mg Prandinu (po 4 dnech jednou) denní dávka 200 mg ketokonazolu) vedla ke zvýšení AUC a Cmax repaglinidu o 15% a 16%, resp. Zvýšení bylo od 20,2 ng / ml do 23,5 ng / ml pro Cmax a od 38,9 ng / ml * h do 44,9 ng / ml * h pro AUC.
Rifampin:
Souběžné podání 600 mg rifampinu a jedné dávky 4 mg Prandinu (po 6 dnech podávání rifampinu 600 mg jednou denně) vedlo k 32% a Cmax repaglinidu o 26%. Pokles byl od 40,4 ng / ml do 29,7 ng / ml pro Cmax a od 56,8 ng / ml * h do 38,7 ng / ml * h pro AUC.
V další studii bylo současné podávání 600 mg rifampinu a jedné dávky 4 mg Prandinu (po 6 dnech jednou denní rifampin 600 mg) vedl k 48% a 17% snížení střední hodnoty AUC repaglinidu a střední hodnoty Cmax resp. Střední poklesy byly od 54 ng / ml * h do 28 ng / ml * h pro AUC a od 35 ng / ml do 29 ng / ml pro Cmax. Přípravek Prandin podávaný samostatně (po 7 dnech rifampinu 600 mg jednou denně) vedl k 80% a 79% snížení AUC repaglinidu a Cmax. Pokles byl z 54 ng / ml * h na 11 ng / ml * h pro AUC a od 35 ng / ml do 7,5 ng / ml pro Cmax.
Levonorgestrel a Ethinyl Estradiol:
Souběžné podávání kombinované tablety 0,15 mg levonorgestrelu a 0,03 mg ethinylestradiolu podávané jednou denně po dobu 21 dnů s 2 mg Prandinu podávané třikrát denně (dny 1-4) a jednorázová dávka v den 5 vedla k 20% zvýšení repaglinidu, levonorgestrelu a ethinylestradiolu Cmax. Zvýšení Cmax repaglinidu bylo od 40,5 ng / ml do 47,4 ng / ml. Parametry AUC ethinylestradiolu se zvýšily o 20%, zatímco hodnoty AUC repaglinidu a levonorgestrelu se nezměnily.
Simvastatin:
Souběžné podávání 20 mg simvastatinu a jedné dávky 2 mg Prandinu (po 4 dnech simvastatinu jednou denně 20 mg a třikrát denně Prandin 2 mg) vedlo k 26% zvýšení Cmax repaglinidu z 23,6 ng / ml na 29,7 ng / ml. AUC se nezměnila.
Nifedipine:
Souběžné podávání 10 mg nifedipinu s jednorázovou dávkou 2 mg Prandinu (po 4 dnech třikrát denně nifedipin 10 mg a třikrát denně Prandin 2 mg) vedl k nezměněným hodnotám AUC a Cmax pro oba drogy.
Clarithromycin:
Souběžné podávání 250 mg klaritromycinu a jedné dávky 0,25 mg Prandinu (po 4 dnech dvakrát) denní 250 mg klaritromycinu) vedlo ke 40% a 67% zvýšení AUC repaglinidu a Cmax, resp. Zvýšení AUC bylo od 5,3 ng / ml * h do 7,5 ng / ml * h a zvýšení Cmax bylo od 4,4 ng / ml do 7,3 ng / ml.
Trimethoprim:
Současné podávání 160 mg trimethoprimu a jedné dávky 0,25 mg Prandinu (po 2 dnech dvakrát denně a jedné dávka třetího dne trimethoprimu 160 mg) vedla k 61% a 41% zvýšení AUC a Cmax repaglinidu, resp. Zvýšení AUC bylo od 5,9 ng / ml * h do 9,6 ng / ml * h a zvýšení Cmax bylo od 4,7 ng / ml do 6,6 ng / ml.
Renální nedostatečnost
Farmakokinetika repaglinidu v jedné dávce a v ustáleném stavu byla srovnávána mezi pacienty s diabetem typu 2 a normální funkcí ledvin (CrCl> 80 ml / min), mírné až střední poškození funkce ledvin (CrCl = 40 - 80 ml / min) a závažné poškození funkce ledvin (CrCl = 20 - 40 ml / min). AUC i Cmax repaglinidu byly podobné u pacientů s normální a mírnou až středně zhoršenou funkcí ledvin (průměrné hodnoty 56,7 ng / ml * h vs 57,2 ng / ml * h a 37,5 ng / ml vs 37,7 ng / ml, v uvedeném pořadí.) Pacienti se závažně sníženou funkcí ledvin měli zvýšenou průměrnou AUC a Cmax hodnoty (98,0 ng / ml * h, respektive 50,7 ng / ml), ale tato studie ukázala pouze slabou korelaci mezi hladinami repaglinidu a kreatininu odbavení. U pacientů s mírnou až středně těžkou renální dysfunkcí není počáteční úprava dávky nutná. Pacienti s diabetem 2. typu, kteří mají závažné poškození funkce ledvin, by však měli zahájit léčbu přípravkem Prandin dávkou 0,5 mg - následně by měli být pacienti pečlivě titrováni. Studie nebyly provedeny u pacientů s clearance kreatininu pod 20 ml / min nebo u pacientů se selháním ledvin vyžadujících hemodialýzu.
Jaterní nedostatečnost
Otevřená studie s jednou dávkou byla provedena u 12 zdravých jedinců a 12 pacientů s chronickým onemocněním jater (CLD) klasifikovaných podle škály Child-Pugh a clearance kofeinu. Pacienti se středně těžkou až těžkou poruchou funkce jater měli vyšší a prodloužené sérové koncentrace celkového i nenavázaného repaglinidu než zdraví jedinci (AUChealthy: 91,6 ng / ml * h; Pacienti s AUCCLD: 368,9 ng / ml * h; Cmax, zdravý: 46,7 ng / ml; Cmax, CLD pacienti: 105,4 ng / ml). AUC byla statisticky korelována s clearance kofeinu. U skupin pacientů nebyl pozorován žádný rozdíl v profilech glukózy. Pacienti se zhoršenou funkcí jater mohou být vystaveni vyšším koncentracím repaglinidu a jeho přidružených metabolitů než pacienti s normální funkcí jater, kteří dostávají obvyklé dávky. Proto by měl být Prandin používán opatrně u pacientů s poškozenou funkcí jater. Je třeba použít delší intervaly mezi úpravou dávky, aby bylo možné plně posoudit odpověď.
Klinické testy
Monoterapeutické zkoušky
Čtyřtýdenní, dvojitě zaslepená, placebem kontrolovaná studie dávka-odpověď byla prováděna u 138 pacientů s diabetem typu 2 s použitím dávek v rozmezí 0,25 až 4 mg užitých při každém ze tří jídel. Terapie prandinem měla za následek snížení glukózy úměrné dávce v celém rozsahu dávky. Hladiny inzulínu v plazmě se po jídle zvýšily a před dalším jídlem se vrátily k výchozím hodnotám. Většina účinku na snížení hladiny glukózy v krvi nalačno byla prokázána během 1-2 týdnů.
Ve dvojitě zaslepené placebem kontrolované tříměsíční studii titrace dávky byly dávky prandinu nebo placeba u každého pacienta zvyšuje se každý týden z 0,25 mg na 0,5, 1 a 2 mg, maximálně na 4 mg, až do plazmatické glukózy nalačno (FPG) úroveň
Prandin vs. Léčení placebem: Průměrné FPG, PPG a HbA1c Změny oproti výchozím hodnotám po 3 měsících léčby:
| ||||||
| FPG (mg / dl) | PPG (mg / dl) | HbA1c (%) | ||||
| PL | R | PL | R | PL | R | |
| Základní hodnota | 215.3 | 220.2 | 245.2 | 261.7 | 8.1 | 8.5 |
|
Změna ze základní linie (při poslední návštěvě) |
30.3 | -31.0* | 56.5 | -47.6* |
1.1 | -0.6* |
|
FPG = hladina glukózy v plazmě nalačno PPG = postprandiální glukóza PL = placebo (N = 33) R = repaglinid (N = 66) |
Další dvojitě zaslepená, placebem kontrolovaná studie byla provedena u 362 pacientů léčených po dobu 24 týdnů. Účinnost preprandiálních dávek 1 a 4 mg byla prokázána snížením hladiny glukózy v krvi nalačno a HbA1c na konci studie. HbA1c pro skupiny léčené Prandinem (kombinované skupiny 1 a 4 mg) na konci studie byl ve srovnání s placebem ošetřenými skupinami snížen skupina u dříve neléčených pacientů au pacientů dříve léčených perorálními hypoglykemickými látkami o 2,1% jednotek a 1,7% jednotek, resp. V této studii s pevnou dávkou byli pacienti, kteří nebyli na orální terapii hypoglykemickými léky, a pacienti relativně dobře glykemická kontrola ve výchozím stavu (HbA1c pod 8%) vykázala větší snížení hladiny glukózy v krvi, včetně vyšší frekvence hypoglykémie. Pacienti, kteří byli dříve léčeni a kteří měli výchozí hladinu HbA1c - 8%, hlásili hypoglykémii stejnou rychlostí jako pacienti randomizovaní do placeba. Nebylo zjištěno průměrné zvýšení tělesné hmotnosti, když byli pacienti dříve léčeni perorálními hypoglykemickými látkami převedeni na Prandin. Průměrný přírůstek hmotnosti u pacientů léčených přípravkem Prandin a dosud neléčených sulfonylmočovinami byl 3,3%.
Dávkování Prandinu ve vztahu k uvolňování inzulínu v souvislosti s jídlem bylo studováno ve třech studiích zahrnujících 58 pacientů. Glykemická kontrola byla udržována během období, ve kterém se měnilo jídlo a dávkování (2, 3 nebo 4 jídla denně; před jídlem x 2, 3 nebo 4) ve srovnání s obdobím 3 pravidelných jídel a 3 dávkami denně (před jídlem x 3). Bylo také prokázáno, že Prandin může být podáván na začátku jídla, 15 minut před nebo 30 minut před jídlem se stejným účinkem na snížení hladiny glukózy v krvi.
Prandin byl srovnáván s jinými sekretagogy inzulinu v jednoročních kontrolovaných studiích, aby se prokázala srovnatelnost účinnosti a bezpečnosti. Hypoglykémie byla hlášena u 16% z 1228 pacientů s Prandinem, 20% ze 417 pacientů s glyburidem a 19% z 81 pacientů s glipizidem. U pacientů léčených Prandinem se symptomatickou hypoglykémií se u žádného nevyvinula kóma ani nevyžadovala hospitalizaci.
Kombinované zkoušky
Přípravek Prandin byl studován v kombinaci s metforminem u 83 pacientů, u nichž nebylo uspokojivě kontrolováno cvičení, dieta a samotný metformin. Dávka prandinu byla titrována po dobu 4 až 8 týdnů, poté následovalo 3měsíční udržovací období. Kombinovaná terapie s prandinem a metforminem vedla k významně většímu zlepšení glykemické kontroly ve srovnání s monoterapií repaglinidem nebo metforminem. HbA1c se zlepšil o 1% jednotky a FPG se snížil o dalších 35 mg / dl. V této studii, kde byla dávka metforminu udržována konstantní, vykazovala kombinovaná léčba Prandinem a metforminem účinky šetřící dávku vzhledem k Prandinu. Vyšší účinnost účinnosti kombinované skupiny bylo dosaženo při nižší denní dávce repaglinidu než ve skupině s monoterapií Prandinem (viz tabulka).
Terapie prandinem a metforminem: průměrné změny oproti výchozím hodnotám glykemických parametrů a hmotnosti po 4 až 5 měsících léčby *
| Prandin | Kombinace | Metformin | |
| N | 28 | 27 | 27 |
|
Střední konečná dávka (mg / den) |
12 |
6 (Prandin) 1500 (metformin) |
1500 |
| HbA1c (% jednotek) | -0.38 | -1.41** | -0.33 |
| FPG (mg / dl) | 8.8 | -39.2** | -4.5 |
| váha (kg) | 3.0 | 2.4*** | -0.90 |
* na základě analýzy zaměřené na léčbu
** p <0,05, pro párové srovnání s Prandinem a metforminem.
*** p <0,05, pro párové srovnání s metforminem.
Režim kombinované léčby Prandinem a pioglitazonem byl srovnáván s monoterapií u obou látek samostatně 24týdenní studie, do které bylo zařazeno 246 pacientů dříve léčených sulfonylmočovinou nebo monoterapií metforminem (HbA1c> 7.0%). Počty léčených pacientů byly: prandin (N = 61), pioglitazon (N = 62), kombinace (N = 123). Dávka prandinu byla titrována během prvních 12 týdnů, poté následovalo 12týdenní udržovací období. Kombinovaná terapie vedla k významně většímu zlepšení glykemické kontroly ve srovnání s monoterapií (obrázek níže). Změny oproti výchozímu stavu u kompletátorů v FPG (mg / dl) a HbA1c (%) byly: -39,8 a -0,1 pro Prandin, -35,3 a -0,1 pro pioglitazon a -92,4 a -1,9 pro kombinaci. V této studii, kde byla dávka pioglitazonu udržována konstantní, vykazovala skupina s kombinační terapií účinky na úsporu dávky vzhledem k Prandinu (viz legenda obrázku). Vyšší účinnost účinnosti kombinované skupiny bylo dosaženo při nižší denní dávce repaglinidu než ve skupině s monoterapií Prandinem. Průměrné zvýšení hmotnosti spojené s kombinací léčby prandinem a pioglitazonem bylo 5,5 kg, 0,3 kg a 2,0 kg.
HbA1c Hodnoty z kombinované studie s prandinem / pioglitazonem
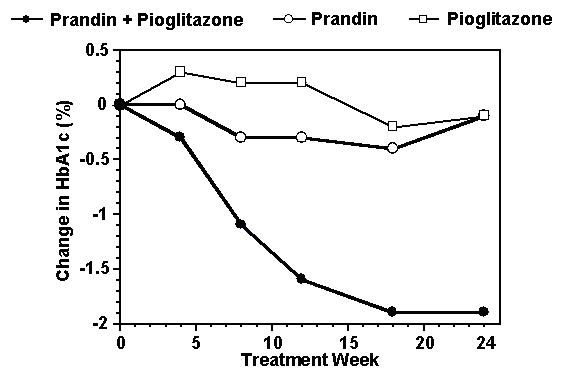
HbA1c hodnoty podle týdne studie u pacientů, kteří dokončili studii (kombinace, N = 101; Prandin, N = 35, pioglitazon, N = 26).
Subjekty s FPG nad 270 mg / dl byly ze studie odebrány.
Dávka pioglitazonu: pevná na 30 mg / den; Medián konečné dávky Prandinu: 6 mg / den pro kombinaci a 10 mg / den pro monoterapii.
Režim kombinované léčby Prandinem a rosiglitazonem byl srovnáván s monoterapií u obou látek samostatně do 24týdenní studie, do které bylo zařazeno 252 pacientů dříve léčených sulfonylmočovinou nebo metforminem (HbA1c > 7.0%). Kombinovaná terapie vedla k významně většímu zlepšení glykemické kontroly ve srovnání s monoterapií (tabulka níže). Glykemické účinky kombinované terapie byly šetrné k dávce vzhledem k celkové denní dávce Prandinu a celkové denní dávce rosiglitazonu (viz legenda v tabulce). Vyšší odezva účinnosti ve skupině kombinované terapie byla dosažena s polovinou střední denní dávky Prandinu a rosiglitazonu ve srovnání s příslušnými skupinami monoterapie. Průměrná změna hmotnosti spojená s kombinovanou terapií byla vyšší než u monoterapie Prandinem.
Průměrné změny oproti výchozím hodnotám glykemických parametrů a hmotnosti ve 24týdenní kombinované studii s prandinem / rosiglitazonem *
| Prandin | Kombinace | Rosiglitazon | |
| N | 63 | 127 | 62 |
| HbA1c (%) | |||
| Základní hodnota | 9.3 | 9.1 | 9.0 |
| Změnit o 24 týdnů | -0.17 | -1.43** | -0.56 |
| FPG (mg / dl) | |||
| Základní hodnota | 269 | 257 | 252 |
| Změnit o 24 týdnů | -54 | -94** | -67 |
| Změna hmotnosti (kg) | +1.3 | +4.5*** | +3.3 |
Konečné střední dávky: rosiglitazon - 4 mg / den pro kombinaci a 8 mg / den pro monoterapii; Prandin - 6 mg / den pro kombinaci a 12 mg / den pro monoterapii |
* na základě analýzy zaměřené na léčbu
** p-hodnota ¤ ‰ ¤ 0,001 pro srovnání s jednou monoterapií
*** p-hodnota <0,001 pro srovnání s Prandinem
horní
Indikace a použití
Prandin je indikován jako doplněk stravy a cvičení ke zlepšení kontroly glykémie u dospělých s diabetes mellitus 2. typu.
horní
Kontraindikace
Prandin je kontraindikován u pacientů s:
- Diabetická ketoacidóza, s nebo bez komatu. Tento stav by měl být léčen inzulínem.
- Diabetes typu 1.
- Známá přecitlivělost na lék nebo jeho neaktivní složky.
horní
Opatření
Všeobecné:
Prandin není indikován k použití v kombinaci s NPH-inzulínem (viz NEŽÁDOUCÍ REAKCE, Kardiovaskulární příhody)
Makrovaskulární výsledky:
Nebyly provedeny žádné klinické studie prokazující přesvědčivé důkazy o snížení makrovaskulárního rizika s přípravkem Prandin nebo jiným antidiabetikem.
Hypoglykémie:
Všechna orální léky snižující hladinu glukózy v krvi, včetně repaglinidu, jsou schopny vyvolat hypoglykémii. Správný výběr pacienta, dávkování a pokyny pro pacienty jsou důležité, aby se zabránilo hypoglykemickým epizodám. Jaterní nedostatečnost může způsobit zvýšené hladiny repaglinidu v krvi a může snížit glukoneogenní kapacitu, což zvyšuje riziko vážné hypoglykémie. Starší, oslabení nebo podvyživení pacienti a pacienti s nadledvinami, hypofýzou, játry nebo těžkými renální nedostatečnost může být zvláště citlivá na hypoglykemický účinek snižování hladiny glukózy drogy.
Hypoglykémie může být obtížné rozpoznat u starších osob au lidí užívajících beta-adrenergní blokátory. Hypoglykémie je pravděpodobnější, když je kalorický příjem nedostatečný, po těžkém nebo dlouhodobém cvičení, při požití alkoholu nebo při použití více než jednoho léčiva snižujícího glukózu.
Frekvence hypoglykémie je vyšší u pacientů s diabetem 2. typu, kteří nebyli dříve léčeni perorálními léky snižujícími hladinu glukózy v krvi (dosud) nebo jejichž HbA1c je nižší než 8%. Prandin by měl být podáván s jídlem, aby se snížilo riziko hypoglykémie.
Ztráta kontroly nad hladinou glukózy v krvi:
Pokud je pacient stabilizovaný na jakémkoli diabetickém režimu vystaven stresu, jako je horečka, trauma, infekce nebo chirurgický zákrok, může dojít ke ztrátě glykemické kontroly. V takových případech může být nutné přerušit podávání Prandinu a podávat inzulín. Účinnost jakéhokoli hypoglykemického léčiva při snižování hladiny glukózy v krvi na požadovanou úroveň u mnoha pacientů klesá období, které může být způsobeno progresí závažnosti diabetu nebo sníženou reakcí na lék. Tento jev je známý jako sekundární selhání, které jej odlišuje od primárního selhání, při kterém je léčivo u jednotlivého pacienta neúčinné, když je léčivo poprvé podáno. Před klasifikováním pacienta jako sekundárního selhání by měla být posouzena adekvátní úprava dávky a dodržování diet.
Informace pro pacienty
Pacienti by měli být informováni o potenciálních rizicích a výhodách Prandinu ao alternativních způsobech léčby. Měli by být také informováni o důležitosti dodržování dietních pokynů, pravidelného cvičebního programu a pravidelného testování hladiny glukózy v krvi a HbA1c. Rizika hypoglykémie, její příznaky a léčba a stavy, které předurčují její vývoj a pacientům a odpovědné rodině by mělo být vysvětleno současné podávání jiných léků snižujících hladinu glukózy členy. Rovněž by mělo být vysvětleno primární a sekundární selhání.
Pacienti by měli být poučeni, aby užívali Prandin před jídlem (2, 3 nebo 4 krát denně předem). Dávky se obvykle užívají do 15 minut od jídla, ale doba se může lišit od bezprostředně před jídlem až po 30 minut před jídlem. Pacienti, kteří vynechají jídlo (nebo přidají další jídlo), by měli být instruováni, aby přeskočili (nebo přidali) dávku pro toto jídlo.
Laboratorní testy
Reakce na všechny diabetické terapie by měla být sledována periodickým měřením krevní hladiny nalačno hladiny glukózy a glykosylovaného hemoglobinu s cílem snížit tyto hladiny směrem k normálu rozsah. Během úpravy dávky lze pro stanovení terapeutické odpovědi použít glukózu nalačno. Poté by měla být monitorována jak glukóza, tak glykosylovaný hemoglobin. Glykosylovaný hemoglobin může být zvláště užitečný pro hodnocení dlouhodobé kontroly glykémie. Postprandiální testování hladiny glukózy může být klinicky užitečné u pacientů, jejichž hladiny glukózy v krvi před jídlem jsou uspokojivé, ale jejichž celková glykemická kontrola (HbA1c) je nedostatečná.
Interakce drog-drogy
Údaje in vitro ukazují, že prandin je metabolizován enzymy cytochromu P450 2C8 a 3A4. V důsledku toho může být metabolismus repaglinidu změněn léky, které ovlivňují tyto enzymové systémy cytochromu P450 indukcí a inhibicí. Proto je třeba postupovat opatrně u pacientů, kteří užívají Prandin a užívají inhibitory a / nebo induktory CYP2C8 a CYP3A4. Účinek může být velmi významný, pokud jsou oba enzymy inhibovány současně, což má za následek podstatné zvýšení plazmatických koncentrací repaglinidu. Léky, o nichž je známo, že inhibují CYP3A4, zahrnují antimykotika, jako je ketokonazol, itrakonazol, a antibakteriální činidla, jako je erytromycin. Léky, o nichž je známo, že inhibují CYP2C8, zahrnují látky jako trimethoprim, gemfibrozil a montelukast. Léky, které indukují enzymové systémy CYP3A4 a / nebo 2C8, zahrnují rifampin, barbituráty a karbamezapin. Vidět KLINICKÁ FARMAKOLOGIE sekce Drogové interakce.
Data in vivo ze studie, která hodnotila současné podávání enzymu 3A4 cytochromu P450 inhibitor, klaritromycin, s Prandinem vedl ke klinicky významnému zvýšení repaglinidu plazmatické hladiny. Kromě toho bylo ve studii, která hodnotila současné podávání Prandinu s trimethoprimem, inhibitorem 2C8 enzymu cytochromu P-450, pozorováno zvýšení plazmatických hladin repaglinidu. Toto zvýšení plazmatických hladin repaglinidu může vyžadovat úpravu dávky Prandinu. Vidět KLINICKÁ FARMAKOLOGIEsekce Drogové interakce.
Údaje in vivo ze studie, která hodnotila současné podávání gemfibrozilu s Prandinem u zdravých osob, vedly k významnému zvýšení hladiny repaglinidu v krvi. Pacienti užívající Prandin by neměli začít užívat gemfibrozil; pacienti užívající gemfibrozil by neměli začít užívat Prandin. Současné použití může mít za následek zesílené a prodloužené účinky repaglinidu na snížení hladiny glukózy v krvi. U pacientů, kteří již užívají Prandin a gemfibrozil, je třeba postupovat opatrně - je třeba sledovat hladiny glukózy v krvi a může být nutné upravit dávku Prandinu. U pacientů užívajících Prandin a gemfibrozil byly hlášeny vzácné postmarketingové události závažné hypoglykémie. Gemfibrozil a itrakonazol měly synergický metabolický inhibiční účinek na Prandin. Pacienti užívající Prandin a gemfibrozil by proto neměli itrakonazol užívat. Vidět KLINICKÁ FARMAKOLOGIE sekce Drogové interakce.
Hypoglykemický účinek perorálních látek snižujících hladinu glukózy v krvi může být zesílen některými léky, včetně nesteroidních protizánětlivých látek a dalších léků které se silně váží na proteiny, salicyláty, sulfonamidy, chloramfenikol, kumariny, probenecid, inhibitory monoaminooxidázy a beta adrenergní blokování agenti. Pokud se takováto léčiva podávají pacientovi, který dostává perorální látky snižující hladinu glukózy v krvi, je třeba pacienta pečlivě sledovat na hypoglykémii. Pokud jsou takováto léčiva odebírána pacientovi, který dostává perorální látky snižující hladinu glukózy v krvi, je třeba pacienta pečlivě sledovat, zda nedochází ke kontrole glykémie.
Některá léčiva mají sklon produkovat hyperglykémii a mohou vést ke ztrátě glykemické kontroly. Mezi tyto léky patří thiazidy a další diuretika, kortikosteroidy, fenothiaziny, produkty štítné žlázy, estrogeny, orální antikoncepční prostředky, fenytoin, kyselina nikotinová, sympatomimetika, léčiva blokující vápníkový kanál a isoniazid. Pokud se tato léčiva podávají pacientovi, který dostává perorální látky snižující hladinu glukózy v krvi, měl by být pacient sledován na ztrátu glykemické kontroly. Pokud jsou tyto léky vysazeny od pacienta, který užívá látky snižující hladinu glukózy v krvi, měl by být pacient pečlivě sledován z hlediska hypoglykémie.
Karcinogeneze, mutageneze a zhoršení plodnosti
Dlouhodobé studie karcinogenity byly prováděny po dobu 104 týdnů v dávkách až do 120 mg / kg tělesné hmotnosti a včetně (krysy) a 500 mg / kg tělesné hmotnosti / den (myši) nebo přibližně 60 a 125krát klinická expozice, v daném pořadí, na mg / m2 základ. U myší nebo samic potkanů nebyl nalezen žádný důkaz karcinogenity. U samců potkanů byl zvýšený výskyt benigních adenomů štítné žlázy a jater. Význam těchto zjištění pro člověka není jasný. Dávky bez účinku pro tato pozorování u samců potkanů byly 30 mg / kg tělesné hmotnosti / den pro nádory štítné žlázy a 60 mg / kg tělesné hmotnosti / den u nádorů jater, které jsou více než 15krát, respektive 30krát, klinická expozice na mg / m2 základ.
Repaglinid byl negenotoxický v řadě studií in vivo a in vitro: Bakteriální mutageneze (Amesův test), in vitro test in vitro buněčné mutace v buňkách V79 (HGPRT), in vitro test chromozomální aberace v lidských lymfocytech, neplánovaná a replikující se syntéza DNA v játrech potkana a in vivo myší a krysí mikronukleus testy.
Plodnost samců a samic potkanů nebyla ovlivněna podáváním repaglinidu v dávkách do 80 mg / kg tělesné hmotnosti / den (ženy) a 300 mg / kg tělesné hmotnosti / den (samci); více než 40krát klinická expozice na základě mg / m2.
Těhotenství
Kategorie těhotenství C
Teratogenní účinky
Bezpečnost u těhotných žen nebyla stanovena. Repaglinid nebyl teratogenní u potkanů nebo králíků při dávkách 40krát (potkanů) a přibližně 0,8krát (králíků) klinické expozice (na základě mg / m2) během těhotenství. Protože studie reprodukce na zvířatech ne vždy predikují lidskou odpověď, měl by být Prandin během těhotenství používán pouze tehdy, je-li to nezbytně nutné.
Protože nejnovější informace naznačují, že abnormální hladiny glukózy v krvi během těhotenství jsou spojeny s vyšším výskytem vrozené abnormality, mnoho odborníků doporučuje, aby byl inzulín používán během těhotenství k udržení hladiny glukózy v krvi co nejblíže normálnímu jak je to možné.
Nonteratogenní účinky
Potomci matek potkanů vystavených repaglinidu při 15násobné klinické expozici na základě mg / m2 během 17 až 22 březosti a během laktací se vyvinuly netterogenní kostní deformity spočívající ve zkrácení, zahuštění a ohnutí humeru během postnatálního doba. Tento účinek nebyl pozorován při dávkách až do 2,5násobku klinické expozice (na základě mg / m2) v 1. až 22. dni těhotenství nebo ve vyšších dávkách podávaných během 1. až 16. dne těhotenství. Relevantní expozice člověka dosud nenastala, a proto nelze stanovit bezpečnost podávání Prandinu během těhotenství nebo laktace.
Kojící matky
Ve studiích reprodukce potkanů byly detekovány měřitelné hladiny repaglinidu v mateřském mléce matek a u mláďat byla pozorována snížená hladina glukózy v krvi. Studie křížového pěstování ukázaly, že v roce 2006 mohly být vyvolány změny skeletu (viz výše Nonteratogenní účinky) kontrolní mláďata ošetřovaná ošetřenými matkami, i když k tomu došlo v menší míře než u mláďat léčených v děloha. Ačkoli není známo, zda se repaglinid vylučuje do lidského mléka, je známo, že se tímto způsobem vylučují perorální látky. Protože u kojících dětí může existovat potenciál hypoglykémie a vzhledem k účinkům na kojící zvířata, a mělo by být učiněno rozhodnutí, zda by měl být přípravek Prandin přerušen u kojících matek, nebo zda by matky měly přestat ošetřovatelství. Pokud je léčba přípravkem Prandin přerušena a pokud není dieta sama o sobě pro kontrolu hladiny glukózy v krvi dostatečná, měla by být zvážena inzulínová terapie.
Pediatrické použití
U pediatrických pacientů nebyly provedeny žádné studie.
Geriatrické použití
V klinických studiích s repaglinidem trvajících 24 týdnů nebo více bylo 415 pacientů starších 65 let. V jednoletých, aktivně kontrolovaných studiích nebyly pozorovány žádné rozdíly v účinnosti nebo nežádoucích příhodách mezi těmito subjekty a ty méně než 65 jiné než očekávané zvýšení kardiovaskulárních příhod pozorované na věk u Prandinu a komparátoru drogy. U starších jedinců nedošlo ke zvýšení frekvence ani závažnosti hypoglykémie. Další uváděné klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a staršími pacienty mladšími pacienty, ale vyšší citlivost některých starších jedinců na léčbu přípravkem Prandin nelze vyloučit ven.
horní
Nežádoucí reakce
Hypoglykémie: Viz OPATŘENÍ aPŘERUŠENÍ sekce.
Prandin byl během klinických hodnocení podán 2931 jednotlivcům. Přibližně 1500 z těchto jedinců s diabetem typu 2 bylo léčeno po dobu alespoň 3 měsíců, 1 000 po dobu nejméně 6 měsíců a 800 po dobu nejméně 1 roku. Většina z těchto jedinců (1228) obdržela Prandin v jedné z pěti jednoletých, aktivně kontrolovaných studií. Srovnávací léky v těchto jednoletých studiích byly orální sulfonylmočovinové léky (SU), včetně glyburidu a glipizidu. V průběhu jednoho roku bylo 13% pacientů s Prandinem ukončeno kvůli nežádoucím účinkům, stejně jako 14% pacientů s SU. Nejčastějšími nežádoucími účinky vedoucími k vysazení byly hyperglykémie, hypoglykémie a související symptomy (viz OPATŘENÍ). Mírná nebo střední hypoglykémie se vyskytla u 16% pacientů s Prandinem, 20% pacientů s glyburidem a 19% pacientů s glipizidem.
Níže uvedená tabulka uvádí běžné nežádoucí účinky u pacientů s Prandinem ve srovnání s placebem (ve studiích 12 až 24 týdnů) a s glyburidem a glipizidem v jednoročních studiích. Profil nežádoucích účinků Prandinu byl obecně srovnatelný s profilem sulfonylmočovin (SU).
Často hlášené nežádoucí účinky (% pacientů) *
| UDÁLOST | Prandin |
PLACEBO | Prandin |
SU |
| N = 352 | N = 108 | N = 1228 | N = 498 | |
| Placebo řízené studie | Aktivně řízené studie | |||
| Metabolické | ||||
| Hypoglykémie | 31** | 7 | 16 | 20 |
| Respirační | ||||
| URI | 16 | 8 | 10 | 10 |
| Sinusitida | 6 | 2 | 3 | 4 |
| Rýma | 3 | 3 | 7 | 8 |
| Bronchitida | 2 | 1 | 6 | 7 |
| Gastrointestinální | ||||
| Nevolnost | 5 | 5 | 3 | 2 |
| Průjem | 5 | 2 | 4 | 6 |
| Zácpa | 3 | 2 | 2 | 3 |
| Zvracení | 3 | 3 | 2 | 1 |
| Dyspepsie | 2 | 2 | 4 | 2 |
| Muskuloskeletální | ||||
| Arthralgia | 6 | 3 | 3 | 4 |
| Bolesti zad | 5 | 4 | 6 | 7 |
| jiný | ||||
| Bolest hlavy | 11 | 10 | 9 | 8 |
| Parestézie | 3 | 3 | 2 | 1 |
| Bolest na hrudi | 3 | 1 | 2 | 1 |
| Infekce močových cest | 2 | 1 | 3 | 3 |
| Porucha zubů | 2 | 0 | <1 | <1 |
| Alergie | 2 | 0 | 1 | <1 |
* Události â ‰ 2% pro skupinu Prandin ve studiích kontrolovaných placebem a â ‰ ¥ události ve skupině placebo
** Viz popis zkoušky v KLINICKÁ FARMAKOLOGIE, Klinické testy.
Kardiovaskulární příhody
V jednoletých studiích porovnávajících prandin se sulfonylmočovinami byl výskyt anginy pectoris srovnatelný (1,8%) pro obě léčby, s výskytem bolesti na hrudi 1,8% pro Prandin a 1,0% pro sulfonylmočoviny. Výskyt dalších vybraných kardiovaskulárních příhod (hypertenze, abnormální EKG, myokard infarkt, arytmie a palpitace) činil 1% a mezi Prandinem a srovnávací léky.
Výskyt celkových závažných kardiovaskulárních nežádoucích příhod, včetně ischémie, byl vyšší v klinických studiích s kontrolovaným komparátorem u repaglinidu (4%) než u sulfonylmočovin (3%). V jednoletých kontrolovaných studiích nebyla léčba přípravkem Prandin spojena s nadměrnou úmrtností ve srovnání s mírami pozorovanými u jiných perorálních terapií hypoglykemickými látkami.
Souhrn závažných kardiovaskulárních příhod (% z celkového počtu pacientů s příhodami) v pokusech porovnávajících prandin se sulfonylmočovinami
| Prandin | SU | |
| Celkem vystaveno | 1228 | 498 |
| Vážné životopisy | 4% | 3% |
| Srdeční ischemické příhody | 2% | 2% |
| Úmrtí v důsledku životopisů | 0.5% | 0.4% |
* glyburid a glipizid
Sedm kontrolovaných klinických studií zahrnovalo kombinovanou terapii Prandinem s NPH-inzulínem (n = 431), inzulínem formulace samotné (n = 388) nebo jiné kombinace (sulfonylmočovina plus NPH-inzulín nebo Prandin plus metformin) (n = 120). U pacientů léčených přípravkem Prandin plus došlo k šesti závažným nežádoucím účinkům na ischemii myokardu NPH-inzulín ze dvou studií a jedna událost u pacientů užívajících inzulínové formulace samostatně z jiné studie studie.
Vzácné nežádoucí účinky (<1% pacientů)
Mezi méně časté nežádoucí klinické nebo laboratorní příhody pozorované v klinických studiích patřily zvýšené jaterní enzymy, trombocytopenie, leukopenie a anafylaktoidní reakce.
Ačkoli nebyl prokázán žádný příčinný vztah s repaglinidem, zkušenosti po uvedení přípravku na trh zahrnují zprávy o následujících vzácných případech nežádoucí účinky: alopecie, hemolytická anémie, pankreatitida, Stevensův-Johnsonův syndrom a těžká jaterní dysfunkce včetně žloutenky a hepatitida.
Kombinovaná terapie s thiazolidindiony
Během 24týdenní klinické studie kombinované terapie prandinem-rosiglitazonem nebo prandinem-pioglitazonem (celkem 250 pacientů v kombinované terapii), hypoglykémie (krevní glukóza <50 mg / dl) se vyskytla u 7% pacientů s kombinovanou terapií ve srovnání se 7% u monoterapie Prandinem a 2% u thiazolidindionu monoterapie.
Periferní edém byl hlášen u 12 z 250 pacientů s kombinací kombinované terapie Prandinem a thiazolidindionem au 3 pacientů ze 124 pacientů s monoterapií thiazolidindionem, přičemž v těchto studiích s přípravkem Prandin nebyly hlášeny žádné případy monoterapie. Při korekci na míru předčasného ukončení léčby v procentech pacientů s procentem pacientů s periferním edémem za 24 týdnů léčby bylo 5% pro kombinovanou terapii Prandin-thiazolidindion a 4% pro thiazolidindion monoterapie. U 2 z 250 pacientů (0,8%) léčených prandin-thiazolidindionovou terapií byly hlášeny edémy s městnavým srdečním selháním. Oba pacienti měli anamnézu ischemické choroby srdeční a zotavili se po léčbě diuretiky. Ve skupině léčené monoterapií nebyly hlášeny žádné srovnatelné případy.
Průměrná změna hmotnosti oproti výchozím hodnotám byla při léčbě Prandin-thiazolidindionem +4,9 kg. Nebyli žádní pacienti na kombinované terapii Prandin-thiazolidindion, kteří měli zvýšení jaterních transamináz (definováno jako trojnásobek horní hranice normálních hladin).
horní
Předávkovat
V klinické studii dostávali pacienti 14 dní rostoucí dávky Prandinu až na 80 mg denně. Kromě nežádoucích účinků souvisejících s plánovaným účinkem snižování hladiny glukózy v krvi bylo málo. Při podávání těchto vysokých dávek nedošlo k hypoglykémii. Hypoglykemické příznaky bez ztráty vědomí nebo neurologických nálezů by měly být léčeny agresivně perorální glukózou a úpravou dávkování léků a / nebo stravovacích návyků. Pečlivé sledování může pokračovat, dokud není lékař přesvědčen, že pacient není v nebezpečí. Pacienti by měli být pečlivě sledováni po dobu nejméně 24 až 48 hodin, protože hypoglykémie se může po zjevném klinickém zotavení opakovat. Neexistuje žádný důkaz, že repaglinid je dialyzovatelný pomocí hemodialýzy.
Závažné hypoglykemické reakce s kómatou, záchvaty nebo jinými neurologickými poruchami se vyskytují jen zřídka, ale představují lékařské naléhavé situace vyžadující okamžitou hospitalizaci. Pokud je diagnostikována nebo existuje podezření na hypoglykemické kóma, měl by být pacient rychle injekčně podán koncentrovaný (50%) roztok glukózy. Poté by měla následovat kontinuální infuze více zředěného (10%) roztoku glukózy rychlostí, která udržuje hladinu glukózy v krvi na úrovni nad 100 mg / dl.
horní
Dávkování a správa
Pro léčbu diabetu 2. typu s přípravkem Prandin neexistuje žádný pevný dávkovací režim.
Hladina glukózy v krvi pacienta by měla být pravidelně sledována, aby se stanovila minimální účinná dávka pro pacienta; detekovat primární selhání, tj. nedostatečné snížení hladiny glukózy v krvi při maximální doporučené dávce léku; a detekovat sekundární selhání, tj. ztrátu odpovídající reakce na snížení hladiny glukózy v krvi po počátečním období účinnosti. Hladiny glykosylovaného hemoglobinu mají význam pro sledování dlouhodobé odpovědi pacienta na terapii.
Krátkodobé podávání Prandinu může být dostatečné během období přechodné ztráty kontroly u pacientů obvykle dobře kontrolovaných dietou.
Dávky prandinu se obvykle užívají do 15 minut od jídla, ale doba se může lišit od bezprostředně před jídlem až po 30 minut před jídlem.
Počáteční dávka
U pacientů, kteří dříve nebyli léčeni nebo jejichž HbA1c je <8%, by měla být počáteční dávka 0,5 mg při každém jídle. U pacientů dříve léčených léky snižujícími hladinu glukózy v krvi, jejichž HbA1c je 8%, je počáteční dávka 1 nebo 2 mg s každým jídlem preprandiálně (viz předchozí odstavec).
Úprava dávky
Úprava dávkování by měla být stanovena na základě odpovědi na krevní glukózu, obvykle nalačno. Testování postprandiální hladiny glukózy může být klinicky užitečné u pacientů, jejichž hladiny glukózy v krvi před jídlem jsou uspokojivé, ale jejichž celková glykemická kontrola (HbA1c) je nedostatečná. Preprandiální dávka by se měla při každém jídle zdvojnásobit až na 4 mg, dokud není dosaženo uspokojivé odezvy na glukózu v krvi. Po každé úpravě dávky by měla uplynout alespoň jeden týden, aby se vyhodnotila odpověď.
Doporučené rozmezí dávky je 0,5 mg až 4 mg užívané s jídlem. Přípravek Prandin může být podáván preprandiálně 2, 3 nebo 4krát denně v reakci na změny v stravovacím schématu pacienta. Maximální doporučená denní dávka je 16 mg.
Správa pacientů
Dlouhodobá účinnost by měla být sledována měřením hladin HbA1c přibližně každé 3 měsíce. Nedodržení vhodného dávkovacího režimu může vyvolat hypoglykémii nebo hyperglykémii. Pacienti, kteří nedodržují předepsaný dietní a lékový režim, jsou náchylnější projevovat neuspokojivou odpověď na terapii včetně hypoglykémie. Dojde-li k hypoglykémii u pacientů užívajících kombinaci Prandinu a thiazolidindionu nebo Prandinu a metforminu, měla by být dávka Prandinu snížena.
Pacienti, kteří dostávají jiné perorální hypoglykemické látky
Pokud se přípravek Prandin použije k nahrazení léčby jinými perorálními hypoglykemickými látkami, může být přípravek Prandin zahájen den po podání poslední dávky. Pacienti by pak měli být pečlivě sledováni z hlediska možného překrývání účinků léků na hypoglykémii. Při přenosu ze sulfonylmočovin s delším poločasem rozpadu (např. Chlorpropamid) na repaglinid může být indikováno pečlivé monitorování po dobu až jednoho týdne nebo déle.
Kombinovaná terapie
Pokud monoterapie Prandinem nevede k dostatečné kontrole glykémie, může být přidán metformin nebo thiazolidindion. Pokud monoterapie metforminem nebo thiazolidindionem nezajišťuje dostatečnou kontrolu, může být přidán Prandin. Počáteční dávka a úprava dávky pro kombinovanou terapii Prandinem je stejná jako pro monoterapii Prandinem. Dávka každého léčiva by měla být pečlivě upravena, aby se stanovila minimální dávka potřebná k dosažení požadovaného farmakologického účinku. Pokud tak neučiníte, může to vést ke zvýšenému výskytu hypoglykemických epizod. Mělo by se použít vhodné monitorování měření FPG a HbA1c, aby se zajistilo, že pacient nebude vystaven nadměrné expozici léku nebo zvýšené pravděpodobnosti selhání sekundárního léku.
horní
Jak dodáván
Tablety Prandin (repaglinid) se dodávají jako nebarevné bikonvexní tablety dostupné v síle 0,5 mg (bílá), 1 mg (žlutá) a 2 mg (broskev). Tablety jsou vyraženy symbolem býka Novo Nordisk (Apis) a zbarveny tak, aby označovaly sílu.
| 0,5 mg tablety (bílé) | Lahve po 100 | NDC 00169-0081-81 |
| Lahve po 500 | NDC 00169-0081-82 | |
| Lahve 1000 | NDC 00169-0081-83 | |
| 1 mg tablety (žluté) | Lahve po 100 | NDC 00169-0082-81 |
| Lahve po 500 | NDC 00169-0082-82 | |
| Lahve 1000 | NDC 00169-0082-83 | |
| 2 mg tablety (broskev) | Lahve po 100 | NDC 00169-0084-81 |
| Lahve po 500 | NDC 00169-0084-82 | |
| Lahve 1000 | NDC 00169-0084-83 |
Uchovávejte při teplotě do 25 ° C.
Chraňte před vlhkostí. Uchovávejte lahve těsně uzavřené.
Výdej v těsných nádobách s bezpečnostními uzávěry.
Licencováno podle amerického patentu č. RE 37,035.
Prandin® je registrovaná ochranná známka společnosti Novo Nordisk A / S.
Vyrobeno v Německu pro
Novo Nordisk Inc.
Princeton, NJ 08540
1-800-727-6500
www.novonordisk-us.com
© 2003-2008 Novo Nordisk A / S
Prandin, informace o pacientech (v prosté angličtině)
Podrobné informace o příznacích, příznacích, příčinách, léčbě cukrovky
naposledy aktualizováno 06/2009
Účelem informací v této monografii není pokrýt všechna možná použití, pokyny, bezpečnostní opatření, lékové interakce nebo nepříznivé účinky. Tyto informace jsou zobecněné a neslouží jako zvláštní lékařská pomoc. Pokud máte dotazy týkající se léčivých přípravků, které užíváte, nebo byste chtěli získat více informací, obraťte se na svého lékaře, lékárníka nebo zdravotní sestru.
zpět k: Procházet všechny léky na cukrovku



