Apidra pro léčbu cukrovky
Název značky: Apidra
Obecný název: Insulin Glulisine
Apidra (inzulín glulisin) je umělý produkt téměř totožný s lidským inzulínem. Používá se k léčbě diabetes mellitus. Použití, dávkování, vedlejší účinky.
Obsah:
Indikace a použití
Dávkování a správa
Kontraindikace
Varování a bezpečnostní opatření
Nežádoucí reakce
Lékové interakce
Použití ve specifických populacích
Předávkování
Popis
Klinická farmakologie
Neklinická toxikologie
Klinické studie
Jak dodáván
Apidra, inzulín glusin, informace o pacientech (v prosté angličtině)
Indikace
Apidra je rychle působící analog lidského inzulínu indikovaný ke zlepšení glykemické kontroly u dospělých a dětí s diabetes mellitus.
horní
Dávkování a správa
Úvahy o dávkování
APIDRA je rekombinantní inzulinový analog, který je ekvipotentní s lidským inzulínem (tj. Jedna jednotka APIDRA má stejný účinek na snížení hladiny glukózy jako jedna jednotka běžného lidského inzulínu), když se podává intravenózně. Při subkutánním podání má APIDRA rychlejší nástup účinku a kratší dobu účinku než běžný lidský inzulín.
Dávkování APIDRA musí být individualizováno. Sledování hladiny glukózy v krvi je nezbytné u všech pacientů, kteří dostávají inzulinovou terapii.
Celková denní potřeba inzulínu se může lišit a je obvykle mezi 0,5 a 1 jednotkou / kg / den. Požadavky na inzulín mohou být změněny během stresu, závažných onemocnění nebo se změnami ve cvičení, stravovacích návycích nebo souběžně podávaných lécích.
Subkutánní podání
APIDRA by měla být podávána do 15 minut před jídlem nebo do 20 minut po jídle.
APIDRA podávaný subkutánní injekcí by měl být obecně používán v režimech se střednědobým nebo dlouhodobě působícím inzulínem.
APIDRA by měla být podávána subkutánní injekcí do břišní stěny, stehna nebo paže. Místa vpichu by se měla střídat ve stejné oblasti (břicho, stehno nebo paže) z jedné injekce na druhou, aby se snížilo riziko lipodystrofie [viz NEŽÁDOUCÍ REAKCE].
Kontinuální subkutánní infuze (inzulínová pumpa)
APIDRA může být podávána kontinuální subkutánní infuzí do břišní stěny. V externích inzulínových pumpách nepoužívejte zředěné nebo smíšené inzulíny. Infuzní místa by se měla střídat ve stejné oblasti, aby se snížilo riziko lipodystrofie [viz NEŽÁDOUCÍ REAKCE]. Počáteční programování externí inzulínové infuzní pumpy by mělo být založeno na celkové denní dávce inzulínu předchozího režimu.
Následující inzulínové pumpy byly použity v klinických studiích APIDRA prováděných společností sanofi-aventis, výrobcem APIDRA:
- Disetronic® H-Tron® plus V100 a D-Tron® s katetrem Disetronic (Rapid ™, Rapid C ™, Rapid D ™ a Tender ™)
- MiniMed® Modely 506, 507, 507c a 508 s katétry MiniMed (Sof-set Ultimate QR ™ a Quick-set ™).
Před použitím jiné inzulínové pumpy s APIDRA si přečtěte štítek pumpy, abyste se ujistili, že pumpa byla vyhodnocena pomocí APIDRA.
Lékaři a pacienti by měli pečlivě vyhodnotit informace o použití pumpy v informacích o předepisování APIDRA, v informačním letáku pro pacienta a v příručce výrobce pumpy. Informace specifické pro APIDRA je třeba dodržovat po dobu používání, frekvenci měnící se infuzní sady nebo jiné podrobnosti specifické pro použití APIDRA, protože informace specifické pro APIDRA se mohou lišit od obecné příručky k čerpadlu instrukce.
Na základě studií in vitro, které prokázaly ztrátu konzervačních látek, metakresolu a degradace inzulínu, by se APIDRA v rezervoáru měla měnit nejméně každých 48 hodin. APIDRA při klinickém použití by neměla být vystavena teplotám vyšším než 37 ° C. [Vidět VAROVÁNÍ A OPATŘENÍ a JAK DODÁVÁ / Skladování a manipulace].
Intravenózní podání
APIDRA může být podávána intravenózně pod lékařským dohledem pro kontrolu glykémie s pečlivým sledováním hladiny glukózy v krvi a sérového draslíku, aby se zabránilo hypoglykémii a hypokalemii. Pro intravenózní použití by měl být APIDRA používán v koncentracích 0,05 jednotek / ml na 1 jednotku / ml inzulínu glulisinu v infuzních systémech používajících vaky z polyvinylchloridu (PVC). Ukázalo se, že APIDRA je stabilní pouze v normálním solném roztoku (0,9% chlorid sodný). Parenterální léčivé přípravky by měly být před podáním vizuálně zkontrolovány na přítomnost částic a změnu barvy, kdykoli to roztok a nádoba dovolí. Nepodávejte inzulínové směsi intravenózně.
Dávkové formy a síly
Apidra 100 jednotek na ml (U-100) je k dispozici jako:
- 10 ml lahvičky
- 3 ml zásobní vložky pro použití v OptiClik® Inzulinové dodávací zařízení
- 3 ml předplněné pero SoloStar
horní
Kontraindikace
Apidra je kontraindikována:
- během epizod hypoglykémie
- u pacientů, kteří jsou přecitlivělí na Apidru nebo na kteroukoli pomocnou látku tohoto přípravku
Při použití u pacientů se známou přecitlivělostí na Apidru nebo její pomocné látky se mohou u pacientů vyvinout lokalizované nebo generalizované reakce přecitlivělosti [viz Nežádoucí reakce].
horní
Varování a bezpečnostní opatření
Úprava dávky a monitorování
Monitorování glukózy je nezbytné u pacientů léčených inzulinovou terapií. Změny inzulínového režimu by měly být prováděny opatrně a pouze pod lékařským dohledem. Změny v síle inzulínu, výrobce, typu nebo způsobu podání mohou mít za následek potřebu změny dávky inzulínu. Může být nutné upravit souběžnou perorální antidiabetickou léčbu.
Stejně jako u všech inzulínových přípravků se může časový průběh účinku přípravku Apidra lišit u různých jedinců nebo v různých dobách stejný jedinec a je závislý na mnoha podmínkách, včetně místa vpichu, místního krevního zásobení nebo místního teplota. U pacientů, kteří změní úroveň své fyzické aktivity nebo stravovacího plánu, může být nutné upravit dávkování inzulínu.
Hypoglykémie
Hypoglykémie je nejčastějším nežádoucím účinkem inzulínové terapie, včetně Apidry. Riziko hypoglykémie se zvyšuje s přísnější kontrolou glykémie. Pacienti musí být vzděláváni, aby rozpoznali a zvládli hypoglykémii. Těžká hypoglykémie může vést k bezvědomí a / nebo křečím a může vést k dočasnému nebo trvalému poškození mozkové funkce nebo smrti. Těžká hypoglykémie vyžadující pomoc jiné osoby a / nebo parenterální infuze glukózy nebo Podávání glukagonu bylo pozorováno v klinických studiích s inzulinem, včetně studií s Apidra.
Načasování hypoglykémie obvykle odráží časový profil účinku podávaných inzulínových formulací. Riziko hypoglykémie může také změnit jiné faktory, jako jsou změny v příjmu potravy (např. Množství jídla nebo načasování jídla), místo vpichu, cvičení a souběžné léky [viz Lékové interakce].
Stejně jako u všech inzulínů buďte opatrní u pacientů s hypoglykémií a u pacientů, kteří mohou být náchylný k hypoglykémii (např. dětská populace a pacienti, kteří se postí nebo mají nepravidelné jídlo) příjem). Schopnost pacienta soustředit se a reagovat může být narušena hypoglykémií. To může představovat riziko v situacích, kdy jsou tyto schopnosti zvláště důležité, jako je řízení vozidla nebo obsluha jiných strojů.
Rychlé změny hladiny glukózy v séru mohou u osob s diabetem vyvolat příznaky podobné hypoglykémii bez ohledu na hodnotu glukózy. Včasné varovné příznaky hypoglykémie mohou být za určitých podmínek odlišné nebo méně výrazné, jako je dlouhodobý diabetes, onemocnění diabetických nervů, použití léků, jako jsou beta-blokátory [viz Lékové interakce], nebo zesílená kontrola diabetu. Tyto situace mohou vést k těžké hypoglykémii (a pravděpodobně ke ztrátě vědomí) před tím, než si pacient uvědomí hypoglykémii.
Intravenózně podávaný inzulín má rychlejší nástup účinku než subkutánně podávaný inzulín, což vyžaduje pečlivější sledování hypoglykémie.
Přecitlivělost a alergické reakce
U inzulínových přípravků, včetně přípravku Apidra, se může objevit závažná, život ohrožující, generalizovaná alergie, včetně anafylaxe [viz Nežádoucí účinky].
Hypokalémie
Všechny inzulínové přípravky, včetně přípravku Apidra, způsobují posun draslíku z extracelulárního do intracelulárního prostoru, což může vést k hypokalemii. Neléčená hypokalémie může způsobit ochrnutí dýchacích cest, ventrikulární arytmii a smrt. Buďte opatrní u pacientů, kteří mohou být ohroženi hypokalémií (např. U pacientů užívajících léky snižující draslík, u pacientů užívajících léky citlivé na sérové koncentrace draslíku). Při intravenózním podání Apidry monitorujte glukózu a draslík často.
Poškození ledvin nebo jater
U pacientů s poškozením ledvin nebo jater může být nutné časté monitorování glukózy a snížení dávky inzulínu [viz Klinická farmakologie].
Míchání inzulínů
Apidra pro subkutánní injekci se nesmí míchat s inzulínovými přípravky jinými než NPH inzulín. Pokud je Apidra smíchána s NPH inzulínem, měl by být Apidra natažen do stříkačky jako první. Injekce by měla být provedena ihned po smíchání.
Nemíchejte Apidru s jinými inzulíny pro intravenózní podání nebo pro použití v kontinuální subkutánní infuzní pumpě.
Apidra pro intravenózní podání nesmí být naředěn jinými roztoky než 0,9% chloridu sodného (normální fyziologický roztok). Účinnost a bezpečnost míchání přípravku Apidra s ředidly nebo jinými inzulíny pro použití v externích subkutánních infuzních pumpách nebyla stanovena.
Podkožní inzulínové infuzní pumpy
Při použití v externí inzulínové pumpě pro subkutánní infuzi by Apidra neměla být ředěna nebo míchána s žádným jiným inzulinem. Apidra v nádrži by se měla měnit nejméně každých 48 hodin. Apidra by neměla být vystavena teplotám vyšším než 37 ° C.
Porucha inzulínové pumpy nebo infuzní soupravy nebo degradace inzulínu může rychle vést k hyperglykémii a ketóze. Je nutná rychlá identifikace a náprava příčiny hyperglykémie nebo ketózy. Může být vyžadována dočasná subkutánní injekce přípravku Apidra. Pacienti, kteří používají kontinuální subkutánní terapii inzulínovou infúzní pumpou, musí být vyškoleni k podávání inzulinu injekcí a musí mít k dispozici alternativní inzulínovou terapii pro případ selhání pumpy. [Vidět Dávkování a správa, Jak dodáván / skladování a manipulace].
Intravenózní podání
Při intravenózním podání přípravku Apidra musí být hladiny glukózy a draslíku pečlivě sledovány, aby se zabránilo potenciálně fatální hypoglykémii a hypokalemii.
Pro intravenózní podání nemíchejte Apidru s jinými inzulíny. Apidra lze ředit pouze v normálním fyziologickém roztoku.
Lékové interakce
Některé léky mohou změnit požadavky na inzulín a riziko hypoglykémie nebo hyperglykémie [viz Lékové interakce].
horní
Nežádoucí reakce
Následující nežádoucí účinky jsou diskutovány jinde:
- Hypoglykémie [Viz Varování a bezpečnostní opatření]
- Hypokalémie [viz Varování a bezpečnostní opatření]
Zkušenosti z klinických pokusů
Vzhledem k tomu, že klinická hodnocení jsou prováděna podle značně odlišných vzorců, nemusí být výskyt nežádoucích účinků hlášený v jedné klinické studii lze snadno porovnat s hodnotami uvedenými v jiné klinické studii a nemusí odrážet míry skutečně pozorované v klinické studii praxe.
Frekvence nežádoucích účinků léků během klinických studií Apidra u pacientů s diabetes mellitus 1. typu a diabetes mellitus 2. typu jsou uvedeny v následujících tabulkách.
Tabulka 1: Léčivé nežádoucí účinky v souhrnných studiích dospělých s diabetem 1. typu (nežádoucí účinky s frekvencí ¥ ‰ 5%)
| APIDRA,% (n = 950) |
Všechny komparátoryA, % (n = 641) |
|
| Nasopharyngitida | 10.6 | 12.9 |
| Hypoglykémieb | 6.8 | 6.7 |
| Infekce horních cest dýchacích | 6.6 | 5.6 |
| Chřipka | 4.0 | 5.0 |
|
A Inzulín lispro, normální lidský inzulín, inzulín aspart b Pouze těžká symptomatická hypoglykémie |
Tabulka 2: Léčivé nežádoucí účinky v sdružených studiích dospělých s diabetem 2. typu (nežádoucí účinky s frekvencí ¥ ‰ 5%)
| APIDRA,% (n = 883) |
Pravidelný lidský inzulín,% (n = 883) |
|
| Infekce horních cest dýchacích | 10.5 | 7.7 |
| Nasopharyngitida | 7.6 | 8.2 |
| Periferní edém | 7.5 | 7.8 |
| Chřipka | 6.2 | 4.2 |
| Arthralgia | 5.9 | 6.3 |
| Hypertenze | 3.9 | 5. |
- Pediatrie
Tabulka 3 shrnuje nežádoucí účinky, které se vyskytují s frekvencí vyšší než 5% v klinické studii u dětí a adolescentů s diabetem 1. typu léčených APIDRA (n = 277) nebo inzulínem lispro (n = 295).
Tabulka 3: Léčba - nežádoucí účinky u dětí a adolescentů s diabetem 1. typu (nežádoucí účinky s frekvencí 5%)
| APIDRA,% (n = 277) |
Lispro,% (n = 295) |
|
| Nasopharyngitida | 9.0 | 9.5 |
| Infekce horních cest dýchacích | 8.3 | 10.8 |
| Bolest hlavy | 6.9 | 11.2 |
| Hypoglykemický záchvat | 6.1 | 4.7 |
- Těžká symptomatická hypoglykémie
Hypoglykémie je nejčastěji pozorovanou nežádoucí reakcí u pacientů užívajících inzulín, včetně Apidry [viz Varování a bezpečnostní opatření]. Míra a incidence těžké symptomatické hypoglykémie, definované jako hypoglykémie vyžadující zásah třetí strany, byly srovnatelné pro všechny léčebné režimy (viz tabulka 4). V klinickém hodnocení fáze 3 měly děti a dospívající s diabetem 1. typu vyšší výskyt těžké symptomatické hypoglykémie ve dvou léčených skupinách ve srovnání s dospělými s typem 1 cukrovka. (viz tabulka 4) Klinické studie].
Tabulka 4: Závažná symptomatická hypoglykémie *
| Diabetes 1. typu Dospělí 12 týdnů s inzulínem glargin |
Diabetes 1. typu Dospělí 26 týdnů s inzulínem glargin |
Diabetes typu 2 Dospělí 26 týdnů s lidským inzulínem NPH |
Diabetes typu 1 Pediatrics 26 týdnů |
||||||
|---|---|---|---|---|---|---|---|---|---|
| Apidra Před jídlem |
Apidra Po jídle |
Pravidelný lidský inzulín | Apidra | Insulin Lispro | Apidra | Pravidelný lidský inzulín | Apidra | Insulin Lispr | |
| * Závažná symptomatická hypoglykémie definovaná jako hypoglykemická událost vyžadující pomoc jiné osoby, která splnila jedno z následujících kritérií: událost byla spojena s plnou krví vztaženou k glukóze v krvi <36 mg / dl nebo událost byla spojena s rychlým zotavením po perorálním podání uhlohydrátů, intravenózní glukóze nebo glukagonu. | |||||||||
| Události za měsíc na pacienta | 0.05 | 0.05 | 0.13 | 0.02 | 0.02 | 0.00 | 0.00 | 0.09 | 0.08 |
| Procento pacientů (n / celkem N) | 8.4% (24/286) | 8.4% (25/296) | 10.1% (28/278) | 4.8% (16/339) |
4.0% (13/333) |
1.4% (6/416) |
1.2% (5/420) |
16.2% (45/277) |
19.3% (57/295) |
- Inzulinová iniciace a zesílení kontroly glukózy
Intenzifikace nebo rychlé zlepšení kontroly glukózy bylo spojeno s přechodným, reverzibilním oftalmologická refrakční porucha, zhoršení diabetické retinopatie a akutní bolestivá periferie neuropatie. Dlouhodobá kontrola glykémie však snižuje riziko diabetické retinopatie a neuropatie.
- Lipodystrofie
Dlouhodobé užívání inzulínu, včetně přípravku Apidra, může způsobit lipodystrofii v místě opakovaných injekcí nebo infuze inzulínu. Lipodystrofie zahrnuje lipohypertrofii (zahušťování tukové tkáně) a lipoatrofii (ředění tukové tkáně) a může ovlivnit absorpci inzulínu. Otočte místa vpichu nebo infuze inzulínu ve stejné oblasti, abyste snížili riziko lipodystrofie. [Vidět Dávkování a správa].
- Přibývání na váze
K nárůstu tělesné hmotnosti může dojít při inzulínové terapii, včetně přípravku Apidra, a byl připisován anabolickým účinkům inzulínu a poklesu glukosurie.
- Periferní edém
Inzulín, včetně přípravku Apidra, může způsobit retenci sodíku a otoky, zejména pokud se dříve nedostatečná metabolická kontrola zlepší intenzivní inzulinovou terapií.
- Nežádoucí reakce s kontinuální subkutánní inzulínovou infuzí (CSII)
Ve 12-týdenní randomizované studii u pacientů s diabetem 1. typu (n = 59) byla rychlost katétru okluze a reakce v místě infuze byly podobné u pacientů léčených Apidrou a inzulínem aspartem (Tabulka 5).
Tabulka 5: Okluze a reakce v místě infuze.
| Apidra (n = 29) |
inzulín aspart (n = 30) |
|
|---|---|---|
| Okluze katétru / měsíc | 0.08 | 0.15 |
| Reakce v místě infuze | 10.3% (3/29) | 13.3% (4/30) |
- Alergické reakce
Místní alergie
Jako u každé inzulínové terapie se u pacientů užívajících Apidru může v místě vpichu objevit zarudnutí, otok nebo svědění. Tyto drobné reakce obvykle ustoupí během několika dní až několika týdnů, ale v některých případech může vyžadovat ukončení léčby Apidrou. V některých případech mohou tyto reakce souviset s jinými faktory než inzulinem, jako jsou dráždivé látky v přípravku na čištění kůže nebo špatná technika injekce.
Systémová alergie
S jakýmkoli inzulinem, včetně Apidry, se může objevit závažná, život ohrožující, generalizovaná alergie, včetně anafylaxe. Generalizovaná alergie na inzulín může způsobit vyrážku celého těla (včetně svědění), dušnost, sípání, hypotenzi, tachykardii nebo diaforézu.
V kontrolovaných klinických studiích trvajících až 12 měsíců byly potenciální systémové alergické reakce hlášeny u 79 pacientů 1833 pacientů (4,3%), kteří dostávali Apidru, a 58 z 1524 pacientů (3,8%), kteří dostávali krátkodobě působící komparátor inzulíny. Během těchto studií byla léčba přípravkem Apidra trvale přerušena u 1 z 1833 pacientů z důvodu možné systémové alergické reakce.
Při použití metakresolu, který je pomocnou látkou přípravku Apidra, byly hlášeny lokalizované reakce a generalizované myalgie.
Produkce protilátek
Ve studii u pacientů s diabetem 1. typu (n = 333) koncentrace inzulínových protilátek, které reagují jak s lidským inzulínem, tak s inzulínem glulisin (zkříženě reaktivní inzulínové protilátky) zůstal během prvních 6 měsíců studie u pacientů léčených Apidra. Během následujících 6 měsíců studie bylo pozorováno snížení koncentrace protilátek. Ve studii u pacientů s diabetem 2. typu (n = 411) bylo podobné zvýšení koncentrace zkříženě reaktivní inzulinové protilátky pozorované u pacientů léčených přípravkem Apidra a pacientů léčených lidským inzulínem během prvních 9 měsíců po podání studie. Poté se koncentrace protilátek u pacientů s Apidrou snížila a u pacientů s lidským inzulínem zůstala stabilní. Neexistovala žádná korelace mezi koncentrací zkříženě reaktivní inzulínové protilátky a změnami v HbA1c, dávkami inzulínu nebo výskytem hypoglykémie. Klinický význam těchto protilátek není znám.
Apidra nevyvolala významnou protilátkovou odpověď ve studii u dětí a dospívajících s diabetem 1. typu.
Postmarketingový zážitek
Následující nežádoucí účinky byly zjištěny při použití přípravku Apidra po schválení.
Protože tyto reakce jsou uváděny dobrovolně z populace nejisté velikosti, není tomu tak vždy možné spolehlivě odhadnout jejich frekvenci nebo navázat kauzální vztah k drogě expozice.
Byly hlášeny medikační chyby, u kterých byly namísto Apidry náhodně podány další inzulíny, zejména dlouhodobě působící inzulíny.
horní
Lékové interakce
Řada léků ovlivňuje metabolismus glukózy a může vyžadovat úpravu dávky inzulínu a zvláště pečlivé sledování.
Léky, které mohou zvýšit účinek inzulínů na snížení hladiny glukózy v krvi, včetně přípravku Apidra, a proto zvyšují riziko hypoglykémie, zahrnují perorální antidiabetika, pramlintid, ACE inhibitory, disopyramid, fibráty, fluoxetin, inhibitory monoaminooxidázy, propoxyfen, pentoxifylin, salicyláty, analogy somatostatinu a sulfonamid antibiotika.
Mezi léčiva, která mohou snižovat účinek Apidry na snižování hladiny glukózy v krvi, patří kortikosteroidy, niacin, danazol, diuretika, sympatomimetika (např. Epinefrin, albuterol, terbutalin), glukagon, isoniazid, deriváty fenothiazinu, somatropin, hormony štítné žlázy, estrogeny, progestogeny (např. v orální antikoncepci), inhibitory proteázy a atypické antipsychotika.
Beta-blokátory, klonidin, lithiové soli a alkohol mohou zvýšit nebo snížit účinek inzulínu na snížení hladiny glukózy v krvi.
Pentamidin může způsobit hypoglykémii, po které může někdy následovat hyperglykémie.
U pacientů užívajících antiadrenergika, jako jsou beta-blokátory, klonidin, guanethidin a reserpin, mohou být příznaky hypoglykémie sníženy nebo chybí.
horní
Použití ve specifických populacích
Těhotenství
Těhotenství Kategorie C: Byly provedeny reprodukční a teratologické studie s inzulinem glulisinem u potkanů a králíků s použitím běžného lidského inzulínu jako komparátoru. Inzulín glulisin byl během březosti podáván samicím potkanů v subkutánních dávkách do 10 jednotek / kg jednou denně (dávka vedla k expozice dvojnásobkem průměrné dávky pro člověka na základě srovnání plochy povrchu těla) a neměl žádné významné toxické účinky na embryo-fetální rozvoj.
Inzulín glulisin byl podáván samicím králíkům v průběhu těhotenství v subkutánních dávkách do 1,5 Jednotky / kg / den (dávka vedoucí k expozici 0,5násobku průměrné dávky pro člověka, vztaženo na plochu povrchu těla) srovnání). Nepříznivé účinky na vývoj embrya a plodu byly pozorovány pouze při dávkách toxických pro matku vyvolávajících hypoglykémii. Zvýšený výskyt ztrát po implantaci a kostních defektů byl pozorován při dávce 1,5 jednotky / kg jednou denně (dávka což má za následek expozici 0,5násobku průměrné dávky pro člověka na základě srovnání plochy povrchu těla), která také způsobila úmrtnost v roce 2006 přehrady. Mírně zvýšený výskyt ztrát po implantaci byl pozorován při příští nižší hladině dávky 0,5 jednotky / kg jednou denně (dávka vedoucí k expozici 0,2 násobek průměrné dávky pro člověka na základě srovnání plochy povrchu těla), která byla také spojena s těžkou hypoglykémií, ale nebyly na tom žádné defekty dávka. U králíků nebyly pozorovány žádné účinky v dávce 0,25 jednotek / kg jednou denně (dávka vedoucí k expozici 0,1násobku průměrné dávky pro člověka na základě srovnání plochy povrchu těla). Účinky inzulínu glulisinu se nelišily od účinků pozorovaných u subkutánního běžného lidského inzulínu ve stejných dávkách a byly přičítány sekundárním účinkům mateřské hypoglykémie.
Neexistují žádné dobře kontrolované klinické studie o použití přípravku Apidra u těhotných žen. Protože studie reprodukce na zvířatech ne vždy predikují lidskou odpověď, mělo by být toto léčivo použito během těhotenství, pouze pokud potenciální přínos odůvodňuje možné riziko pro plod. Pro pacienty s diabetem nebo s gestačním diabetem v anamnéze je nezbytné udržovat dobrou metabolickou kontrolu před početí a během těhotenství. Požadavky na inzulín se mohou během prvního trimestru snižovat, obvykle se zvyšují během druhého a třetího trimestru a po porodu rychle klesají. U těchto pacientů je nezbytné pečlivé sledování hladiny glukózy.
Kojící matky
Není známo, zda se inzulín glulisin vylučuje do mateřského mléka. Protože se mnoho léčiv vylučuje do mateřského mléka, je třeba při podávání přípravku Apidra kojící ženě postupovat opatrně. Použití přípravku Apidra je kompatibilní s kojením, ale ženy s diabetem, které kojí, mohou vyžadovat úpravu dávky inzulínu.
Pediatrické použití
Bezpečnost a účinnost subkutánních injekcí Apidry byla stanovena u dětských pacientů (ve věku 4 až 17 let) s diabetem 1. typu [viz Klinické studie]. Přípravek Apidra nebyl studován u pediatrických pacientů s diabetem typu 1 mladších než 4 roky a u pediatrických pacientů s diabetem typu 2.
Stejně jako u dospělých musí být dávka přípravku Apidra u pediatrických pacientů individualizována na základě metabolických potřeb a častého sledování hladiny glukózy v krvi.
Geriatrické použití
V klinických studiích (n = 2408) byl přípravek Apidra podáván 147 pacientům ve věku 65 let a 27 pacientům ve věku 75 let. Většina této malé podskupiny starších pacientů měla diabetes 2. typu. Změna hodnot HbA1c a frekvence hypoglykémie se nelišila podle věku. Při podávání Apidry geriatrickým pacientům je však třeba postupovat opatrně.
horní
Předávkování
Nadbytek inzulínu může způsobit hypoglykémii a zejména při intravenózním podání hypokalémie. Mírné epizody hypoglykémie lze obvykle léčit perorální glukózou. Může být nutné upravit dávkování léků, vzorce jídla nebo cvičení. Závažnější epizody hypoglykémie s kómatem, záchvaty nebo neurologickým poškozením mohou být léčeny intramuskulárním / subkutánním glukagonem nebo koncentrovanou intravenózní glukózou. Po zjevném klinickém zotavení může být nutný trvalý příjem uhlohydrátů a jejich sledování, protože hypoglykémie se může opakovat. Hypokalémie musí být náležitě napravena.
Popis
Apidra® (injekce inzulínu glulisinu [rDNA původ]) je rychle působící analog lidského inzulínu používaný ke snižování hladiny glukózy v krvi. Inzulín glulisin je produkován technologií rekombinantní DNA využívající nepatogenní laboratorní kmen Escherichia coli (K12). Inzulín glulisin se liší od lidského inzulínu v tom, že aminokyselina asparagin v poloze B3 je nahrazena lysinem a lysin v poloze B29 je nahrazen kyselinou glutamovou. Chemicky je inzulín glulisin 3B-lysin-29B-glutamová kyselina-lidský inzulín, má empirický vzorec C258H384N64O78S6 a molekulovou hmotnost 5823 a má následující strukturní vzorec:

Apidra je sterilní, vodný, čirý a bezbarvý roztok. Každý mililitr Apidry obsahuje 100 jednotek (3,49 mg) inzulínu glulisinu, 3,15 mg metakresolu, 6 mg trometaminu, 5 mg chloridu sodného, 0,01 mg polysorbátu 20 a vodu na injekci. Apidra má pH přibližně 7,3. PH se upraví přidáním vodných roztoků kyseliny chlorovodíkové a / nebo hydroxidu sodného.
horní
Klinická farmakologie
Mechanismus účinku
Regulace metabolismu glukózy je primární aktivita inzulínů a analogů inzulínu, včetně inzulínu glulisinu. Inzuliny snižují hladinu glukózy v krvi stimulací periferní absorpce glukózy kosterním svalem a tukem a inhibicí produkce glukózy v játrech. Inzuliny inhibují lipolýzu a proteolýzu a zvyšují syntézu proteinů.
Aktivita Apidry a běžného lidského inzulinu na snížení hladiny glukózy je při intravenózním podání ekvipotentní. Po subkutánním podání je účinek přípravku Apidra rychlejší při nástupu a kratší trvání ve srovnání s běžným lidským inzulínem. [Viz farmakodynamika].
Farmakodynamika
Studie u zdravých dobrovolníků a pacientů s diabetem prokázaly, že Apidra má rychlejší účinek nástup účinku a kratší doba aktivity než běžný lidský inzulín, pokud je podán subkutánně.
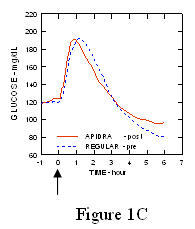
Ve studii u pacientů s diabetem 1. typu (n = 20) byly profily Apidry a glukózy snižující hladinu glukózy normální lidský inzulín byl hodnocen v různých časech ve vztahu ke standardnímu jídlu v dávce 0,15 Jednotky / kg. (Obrázek 1.)
Maximální exkurze glukózy v krvi (Î ”GLUmax; základní hladina odečtené koncentrace glukózy) pro Apidru injikovanou 2 minuty před jídlem byla 65 mg / dl oproti 64 mg / dl pro normální člověka inzulín injikovaný 30 minut před jídlem (viz obrázek 1A) a 84 mg / dl pro normální lidský inzulín injikovaný 2 minuty před jídlem (viz obrázek) 1B). Maximální exkurze glukózy v krvi pro Apidru injikovanou 15 minut po začátku jídla byla 85 mg / dl ve srovnání s 84 mg / dl normálního lidského inzulínu injikovaného 2 minuty před jídlem (viz obrázek 5) 1C).
Obrázek 1. Sériová průměrná hladina glukózy v krvi odebraná do 6 hodin po jedné dávce Apidry a běžného lidského inzulínu. Apidra podávaná 2 minuty (Apidra - pre) před zahájením jídla ve srovnání s běžným lidským inzulínem podávaným 30 minut (pravidelné - 30 min) před zahájením jídla (obrázek 1A) a ve srovnání s běžným lidským inzulínem (Regular - pre) podaným 2 minuty před jídlem (obrázek 1) 1B). Apidra podaná 15 minut (Apidra - post) po začátku jídla ve srovnání s běžným lidským inzulínem (Regular - pre) podaným 2 minuty před jídlem (obrázek 1C). Na ose x nula (0) je začátek 15minutového jídla.
 |
 |
 |
 |
V randomizované otevřené otevřené křížové studii dostalo intravenózně 16 zdravých mužů infuze Apidry nebo běžného lidského inzulínu solným ředidlem rychlostí 0,8 mililitru / kg / min po dobu dvou hodin. Infuze stejné dávky Apidry nebo běžného lidského inzulínu produkovala ekvivalentní likvidaci glukózy v ustáleném stavu.
Farmakokinetika
Absorpce a biologická dostupnost
Farmakokinetické profily u zdravých dobrovolníků a pacientů s diabetem (typ 1 nebo typ 2) prokázaly, že absorpce inzulínu glulisinu byla rychlejší než absorpce běžného lidského inzulínu.
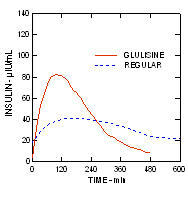
Ve studii u pacientů s diabetem 1. typu (n = 20) po subkutánním podání 0,15 jednotek / kg byl střední čas do maximální koncentrace (Tmax) byl 60 minut (rozmezí 40 až 120 minut) a maximální koncentrace (Cmax) byla 83 mikroUnits / ml (rozmezí 40 až 131 mikroUnits / ml) pro inzulin glulisin ve srovnání se střední Tmax 120 minut (rozmezí 60 až 239 minut) a Cmax 50 mikroUnits / ml (rozmezí 35 až 71 mikroUnits / ml) pro normální lidi inzulín. (Obrázek 2)
Obrázek 2. Farmakokinetické profily inzulínu glulisinu a běžného lidského inzulínu u pacientů s diabetem typu 1 po dávce 0,15 jednotek / kg.

Inzulín glulisin a běžný lidský inzulín byly podávány subkutánně v dávce 0,2 jednotek / kg v a studie euglykemické svorky u pacientů s diabetem 2. typu (n = 24) a indexem tělesné hmotnosti (BMI) mezi 20 a 36 kg / m2. Střední doba do maximální koncentrace (Tmax) byla 100 minut (rozmezí 40 až 120 minut) a střední maximální koncentrace (Cmax) byla 84 mikroUnits / ml (rozmezí 53 až 165 mikroUnits / ml) pro inzulín glulisin ve srovnání se střední Tmax 240 minut (rozmezí 80 až 360 minut) a střední Cmax 41 mikroUnits / ml (rozmezí 33 až 61 mikroUnits / ml) pro normální lidský inzulín. (Obrázek 3)
Obrázek 3. Farmakokinetické profily inzulínu glulisinu a běžného lidského inzulínu u pacientů s diabetem typu 2 po subkutánní dávce 0,2 jednotek / kg.
Když byl Apidra injikován subkutánně do různých částí těla, profily časové koncentrace byly podobné. Absolutní biologická dostupnost inzulínu glulisinu po subkutánním podání je přibližně 70%, bez ohledu na oblast injekce (břicho 73%, deltoid 71%, stehno 68%).
V klinické studii u zdravých dobrovolníků (n = 32) byla celková biologická dostupnost inzulínu glulisinu po subkutánním podání podobná injekce inzulínu glulisinu a NPH inzulínu (předem smíchané v injekční stříkačce) a po samostatné současné subkutánní injekci injekce. Po předběžném smíchání došlo k 27% zeslabení maximální koncentrace (Cmax) Apidry; doba do maximální koncentrace (Tmax) však nebyla ovlivněna. Nejsou k dispozici žádné údaje o míchání přípravku Apidra s jinými inzulínovými přípravky než s inzulínem NPH. [Vidět Klinické studie].
Distribuce a eliminace
Distribuce a eliminace inzulínu glulisinu a běžného lidského inzulínu po intravenózním podání podání je podobné s objemy distribuce 13 a 21 L a poločasy 13 a 17 minut, resp. Po subkutánním podání je inzulín glulisin vylučován rychleji než běžný lidský inzulín se zdánlivým poločasem 42 minut ve srovnání s 86 minutami.
Klinická farmakologie u specifických populací
Pediatričtí pacienti
Farmakokinetické a farmakodynamické vlastnosti Apidry a běžného lidského inzulínu byly hodnoceny v a studie prováděná u dětí ve věku 7 až 11 let (n = 10) a adolescentů ve věku 12 až 16 let (n = 10) s typem 1 cukrovka. Relativní rozdíly ve farmakokinetice a farmakodynamice mezi Apidrou a běžným lidským inzulínem v roce 2006 tito pacienti s diabetem typu 1 byli podobní jako u zdravých dospělých jedinců a dospělých s typem 1 cukrovka.
Závod
Studie na 24 zdravých bělošských a japonských subjektech srovnávala farmakokinetiku a farmakodynamiku po subkutánní injekci inzulínu glulisinu, inzulínu lispro a běžného lidského inzulínu. Při subkutánní injekci inzulínu glulisin měli japonští jedinci vyšší počáteční expozici (33%) pro poměr AUC (0-1h) k AUC (0-svorkový konec) než Kavkazané (21%), ačkoli celkové expozice byly podobný. Podobné nálezy byly pozorovány u inzulínu lispro a běžného lidského inzulínu.
Obezita
Inzulín glulisin a běžný lidský inzulín byly podávány subkutánně v dávce 0,3 jednotek / kg v a studie euglykemické svorky u obézních nediabetických osob (n = 18) s indexem tělesné hmotnosti (BMI) mezi 30 a 40 kg / m2. Střední doba do maximální koncentrace (Tmax) byla 85 minut (rozmezí 49 až 150 minut) a střední maximální koncentrace (Cmax) byla 192 mikroUnits / ml (rozmezí 98 až 380 mikroUnits / ml) pro inzulín glulisin ve srovnání se střední Tmax 150 minut (rozmezí 90 až 240 minut) a střední Cmax 86 mikroUnits / ml (rozmezí 43 až 175 mikroUnits / ml) pro normální člověka inzulín.
Rychlejší nástup účinku a kratší trvání aktivity Apidry a inzulínu lispro ve srovnání s běžným lidským inzulínem byly udržovány v obézní nediabetické populaci (n = 18). (Obrázek 4)
Obrázek 4. Rychlosti infuze glukózy (GIR) ve studii euglykemické svorky po subkutánní injekci 0,3 jednotky / kg Apidry, inzulínu lispro nebo běžného lidského inzulínu u obézní populace.

Poškození ledvin
Studie s lidským inzulínem prokázaly zvýšené hladiny cirkulujícího inzulínu u pacientů se selháním ledvin. Ve studii provedené na 24 nediabetických osobách s normální funkcí ledvin (ClCr> 80 ml / min), středně závažným poškozením ledvin (30–50 ml / min) a závažným poškozením ledvin (Varování a opatření).
Poškození jater
Účinek poškození jater na farmakokinetiku a farmakodynamiku přípravku Apidra nebyl studován. Některé studie s lidským inzulínem prokázaly zvýšené hladiny cirkulujícího inzulínu u pacientů se selháním jater. [Vidět Varování a bezpečnostní opatření].
Rod
Účinek pohlaví na farmakokinetiku a farmakodynamiku přípravku Apidra nebyl studován.
Těhotenství
Účinek těhotenství na farmakokinetiku a farmakodynamiku přípravku Apidra nebyl studován.
Kouření
Účinek kouření na farmakokinetiku a farmakodynamiku přípravku Apidra nebyl studován.
horní
Neklinická toxikologie
Karcinogeneze, mutageneze, poškození plodnosti
Standardní dvouleté studie karcinogenity u zvířat nebyly provedeny. U potkanů Sprague Dawley byla provedena 12měsíční studie toxicity po opakované dávce s inzulínem glulisin v subkutánních dávkách 2,5, 5, 20 nebo 50 jednotek / kg dvakrát denně (dávka vedoucí k expozici 1, 2, 8 a 20násobku průměrné dávky pro člověka, podle plochy povrchu těla) srovnání).
U samic potkanů, kterým byl podáván inzulín glulisin, byl ve srovnání s neléčenými kontrolami vyšší výskyt nádorů mléčné žlázy závislý na dávce. Incidence nádorů prsu u inzulínu glulisinu a běžného lidského inzulínu byla podobná. Význam těchto zjištění pro člověka není znám. Inzulín glulisin nebyl mutagenní v následujících testech: Amesův test, in vitro savčí chromozom aberační test v buňkách čínského křečka V79 a in vivo mikronukleární test erytrocytů savců in vivo krysy.
Ve studiích fertility u samců a samic potkanů v subkutánních dávkách do 10 jednotek / kg jednou denně (dávka vedoucí k expozici 2krát větší než je průměrná dávka u člověka) dávka, na základě srovnání plochy povrchu těla), nebyly zaznamenány žádné jasné nepříznivé účinky na mužskou a ženskou plodnost nebo na celkovou reprodukční výkonnost zvířat pozorováno.
horní
Klinické studie
Bezpečnost a účinnost přípravku Apidra byla studována u dospělých pacientů s diabetem 1. a 2. typu (n = 1833) au dětí a dospívajících (4 až 17 let) s diabetem 1. typu (n = 572). Primárním parametrem účinnosti v těchto studiích byla kontrola glykémie, hodnocená pomocí glykovaného hemoglobinu (GHb uváděný jako ekvivalent HbA1c).
Diabetes typu 1 pro dospělé
U pacientů s diabetem 1. typu byla provedena 26-týdenní, randomizovaná, otevřená, aktivně kontrolovaná, non-inferiorita studie. bezpečnost a účinnost Apidry (n = 339) ve srovnání s inzulínem lispro (n = 333) při subkutánním podání do 15 minut před jídlo. Inzulín glargin byl podáván jednou denně večer jako základní inzulín. Před randomizací bylo provedeno 4-týdenní záběžné období s inzulinem lispro a inzulínem glargin. Většina pacientů byla bělošská (97%). Padesát osm procent pacientů byli muži. Průměrný věk byl 39 let (rozmezí 18 až 74 let). Glykemická kontrola, počet denních krátkodobě působících injekcí inzulínu a celkové denní dávky Apidry a inzulínu lispro byly ve dvou léčebných skupinách podobné (tabulka 6).
Tabulka 6: Diabetes Mellitus 1. typu - dospělý
| Délka léčby Ošetření v kombinaci s: |
26 týdnů Inzulín glargin |
|
|---|---|---|
| Apidra | Insulin Lispro | |
| ||
| Glykovaný hemoglobin (GHb)* (%) | ||
| Počet pacientů | 331 | 322 |
| Střední hodnota | 7.6 | 7.6 |
| Upravená průměrná změna od základní hodnoty | -0.1 | -0.1 |
| Rozdíl v léčbě: Apidra - Insulin Lispro | 0.0 | |
| 95% CI pro rozdíl v léčbě | (-0.1; 0.1) | |
| Bazální dávka inzulínu (jednotky / den) | ||
| Střední hodnota | 24 | 24 |
| Upravená průměrná změna od základní hodnoty | 0 | 2 |
| Krátkodobě působící dávka inzulínu (jednotky / den) | ||
| Střední hodnota | 30 | 31 |
| Upravená průměrná změna od základní hodnoty | -1 | -1 |
| Průměrný počet injekcí krátkodobě působícího inzulínu za den | 3 | 3 |
| Tělesná hmotnost (kg) | ||
| Střední hodnota | 73.9 | 74.1 |
| Průměrná změna oproti základní linii | 0.6 | 0.3 |
Diabetes 2. typu
U pacientů léčených inzulinem s diabetem 2. typu byla provedena 26-týdenní, randomizovaná, otevřená, aktivně kontrolovaná, non-inferiorita studie. bezpečnost a účinnost přípravku Apidra (n = 435) podaného do 15 minut před jídlem ve srovnání s běžným lidským inzulínem (n = 441) podaným 30 až 45 minut před jídlo. Lidský inzulín NPH byl podáván dvakrát denně jako bazální inzulín. Všichni pacienti se účastnili čtyřtýdenního záběhu s běžným lidským inzulínem a lidským inzulínem NPH. Osmdesát pět procent pacientů bylo bělošských a 11% černošských. Průměrný věk byl 58 let (rozmezí 26 až 84 let). Průměrný index tělesné hmotnosti (BMI) byl 34,6 kg / m2. Při randomizaci 58% pacientů užívalo perorální antidiabetikum. Tito pacienti byli instruováni, aby pokračovali v používání svého perorálního antidiabetika ve stejné dávce po celou dobu pokusu. Většina pacientů (79%) smíchala krátkodobě působící inzulín s lidským inzulínem NPH bezprostředně před injekcí. Snížení oproti výchozímu stavu u GHb bylo mezi dvěma léčenými skupinami podobné (viz tabulka 7). Nebyly pozorovány žádné rozdíly mezi skupinami Apidra a normálními lidskými inzulíny, pokud jde o počet denních krátkodobě působících inzulínových injekcí nebo bazálních nebo krátkodobě působících dávek inzulínu. (Viz tabulka 7.)
Tabulka 7: Diabetes typu 2 Mellitus-Adult
| Délka léčby | 26 týdnů | |
|---|---|---|
| Ošetření v kombinaci s: | Lidský inzulín NPH | |
| Apidra | Pravidelný lidský inzulín | |
| ||
| Glykovaný hemoglobin (GHb)* (%) | ||
| Počet pacientů | 404 | 403 |
| Střední hodnota | 7.6 | 7.5 |
| Upravená průměrná změna od základní hodnoty | -0.5 | -0.3 |
| Rozdíl v léčbě: Apidra - běžný lidský inzulín | -0.2 | |
| 95% CI pro rozdíl v léčbě | (-0.3; -0.1) | |
| Bazální dávka inzulínu (jednotky / den) | ||
| Střední hodnota | 59 | 57 |
| Upravená průměrná změna od základní hodnoty | 6 | 6 |
| Krátkodobě působící dávka inzulínu (jednotky / den) | ||
| Střední hodnota | 32 | 31 |
| Upravená průměrná změna od základní hodnoty | 4 | 5 |
| Průměrný počet injekcí krátkodobě působícího inzulínu za den | 2 | 2 |
| Tělesná hmotnost (kg) | ||
| Střední hodnota | 100.5 | 99.2 |
| Průměrná změna oproti základní linii | 1.8 | 2.0 |
Diabetes typu 1: Dospělí: Před a po jídle
U pacientů s 12 týdny byla provedena randomizovaná, otevřená, aktivně kontrolovaná, neferiorní studie diabetes 1. typu k posouzení bezpečnosti a účinnosti přípravku Apidra podávaného v různých časech s ohledem na a jídlo. Apidra byla podávána subkutánně buď do 15 minut před jídlem (n = 286) nebo bezprostředně po a jídlo (n = 296) a normální lidský inzulín (n = 278) byly podány subkutánně 30 až 45 minut před jídlo. Inzulín glargin byl podáván jednou denně před spaním jako základní inzulín. Bylo provedeno čtyřtýdenní období záběhu s běžným lidským inzulínem a inzulínem glargin následovaným randomizací. Většina pacientů byla bělošská (94%). Průměrný věk byl 40 let (rozmezí 18 až 73 let). Glykemická kontrola (viz tabulka 8) byla srovnatelná pro 3 léčebné režimy. V celkovém denním počtu krátkodobě působících inzulínových injekcí nebyly pozorovány žádné změny oproti výchozím hodnotám. (Viz tabulka 8.)
Tabulka 8: Před a po jídle u diabetu typu 1 Mellitus-Adult
| Délka léčby Ošetření v kombinaci s: |
12 týdnů inzulín glargin |
12 týdnů inzulín glargin |
12 týdnů inzulín glargin |
|---|---|---|---|
| Apidra před jídlem |
Apidra po jídle |
Pravidelný lidský inzulín | |
| |||
| Glykovaný hemoglobin (GHb)* (%) | |||
| Počet pacientů | 268 | 276 | 257 |
| Střední hodnota | 7.7 | 7.7 | 7.6 |
| Upravená průměrná změna od základní hodnoty†| -0.3 | -0.1 | -0.1 |
| Bazální dávka inzulínu (jednotky / den) | |||
| Střední hodnota | 29 | 29 | 28 |
| Upravená průměrná změna od základní hodnoty | 1 | 0 | 1 |
| Krátkodobě působící dávka inzulínu (jednotky / den) | |||
| Střední hodnota | 29 | 29 | 27 |
| Upravená průměrná změna od základní hodnoty | -1 | -1 | 2 |
| Průměrný počet injekcí krátkodobě působícího inzulínu za den | 3 | 3 | 3 |
| Tělesná hmotnost (kg) | |||
| Střední hodnota | 79.2 | 80.3 | 78.9 |
| Průměrná změna oproti základní linii | 0.3 | -0.3 | 0.3 |
Diabetes-pediatričtí pacienti typu 1
U dětí a adolescentů starších než 4 let s typem 1 byla provedena 26týdenní, randomizovaná, otevřená, aktivně kontrolovaná, neferiorní studie. diabetes mellitus k posouzení bezpečnosti a účinnosti přípravku Apidra (n = 277) ve srovnání s inzulínem lispro (n = 295) při subkutánním podání do 15 minut před jídlo. Pacienti také dostávali inzulín glargin (podávaný jednou denně večer) nebo NPH inzulín (podávaný jednou ráno a jednou večer). Před randomizací bylo provedeno 4-týdenní záběžné období s inzulínem lispro a inzulínem glargin nebo NPH. Většina pacientů byla bělošská (91%). Padesát procent pacientů bylo mužů. Průměrný věk byl 12,5 let (rozmezí 4 až 17 let). Průměrný BMI byl 20,6 kg / m2. Glykemická kontrola (viz tabulka 9) byla srovnatelná pro oba léčebné režimy.
Tabulka 9: Výsledky z 26týdenní studie u dětských pacientů s diabetes mellitus 1. typu
| Apidra | Lispro | |
|---|---|---|
| Počet pacientů | 271 | 291 |
| Bazální inzulín | NPH nebo inzulín glargin | NPH nebo inzulín glargin |
| ||
| Glykovaný hemoglobin (GHb)* (%) | ||
| Střední hodnota | 8.2 | 8.2 |
| Upravená průměrná změna od základní hodnoty | 0.1 | 0.2 |
| Rozdíl v léčbě: Střední (95% interval spolehlivosti) | -0.1 (-0.2, 0.1) | |
| Bazální dávka inzulínu (jednotky / kg / den) | ||
| Střední hodnota | 0.5 | 0.5 |
| Průměrná změna oproti základní linii | 0.0 | 0.0 |
| Krátkodobě působící dávka inzulínu (jednotky / kg / den) | ||
| Střední hodnota | 0.5 | 0.5 |
| Průměrná změna oproti základní linii | 0.0 | 0.0 |
| Průměrný počet injekcí krátkodobě působícího inzulínu za den | 3 | 3 |
| Základní průměrná tělesná hmotnost (kg) | 51.5 | 50.8 |
| Průměrná změna hmotnosti od základní hodnoty (kg) | 2.2 | 2.2 |
Diabetes typu 1: Dospělí: Kontinuální subkutánní infuze inzulínu
12denní randomizovaná, aktivní kontrolní studie (Apidra versus inzulín aspart) prováděná u dospělých s diabetem 1. typu (Apidra n = 29, inzulín aspart n = 30) hodnotil použití Apidry v externím kontinuálním subkutánním inzulínu čerpadlo. Všichni pacienti byli běloši. Průměrný věk byl 46 let (rozmezí 21 až 73 let). Průměrný GHb vzrostl od výchozího stavu do koncového bodu v obou léčených skupinách (ze 6,8% na 7,0% u Apidry; od 7,1% do 7,2% pro inzulín aspart).
horní
Jak dodáván / skladování a manipulace
Jak dodáván
| |
| Apidra 100 jednotek na ml (U-100) je k dispozici jako: | |
| 10 ml lahvičky | NDC 0088-2500-33 |
| 3 ml náplňový systém*, balení po 5 | NDC 0088-2500-52 |
| 3 ml předplněné pero SoloStar, balení po 5 kusech | NDC 0088-2502-05 |
Jehly na pera nejsou součástí balení.
Jehly na pera BD Ultra-Fine ™1, které se používají ve spojení s OptiClikem, se prodávají samostatně a vyrábí je společnost Becton Dickinson and Company.
Solostar je kompatibilní se všemi jehly na pera od Becton Dickinson and Company, Ypsomed a Owen Mumford.
Úložný prostor
Nepoužívejte po uplynutí doby použitelnosti (viz krabička a obal).
Neotevřená lahvička / kazetový systém / SoloStar
Neotevřené lahvičky Apidra, zásobní systémy a SoloStar by měly být skladovány v chladničce (2 ° C - 8 ° C). Chraňte před světlem. Apidra by neměla být uchovávána v mrazničce a neměla by se nechat zmrznout. Zlikvidujte, pokud byl zmrazený.
Neotevřené injekční lahvičky / zásobníkový systém / SoloStar neuchovávané v chladničce musí být spotřebovány do 28 dnů.
Otevřená (v provozu) lahvička:
Otevřené injekční lahvičky, ať už chlazené nebo chlazené, musí být použity do 28 dnů. Pokud není možné chlazení, může být používaná otevřená injekční lahvička ponechána nerafigerovaná po dobu až 28 dnů od přímého tepla a světla, dokud není teplota vyšší než 25 ° C.
Otevřený (v provozu) systém kazet:
Otevřený (v provozu) systém náplní vložený do OptiCliku® NESMÍ být chlazený, ale měl by být uchováván při teplotě do 25 ° C od přímého tepla a světla. Otevřený (v provozu) systém kazet musí být zlikvidován po 28 dnech. Neskladujte OptiClik®, ať už se zásobníkem nebo bez něj, v chladničce.
Otevřené předplněné pero SoloStar (v provozu):
Otevřený (v provozu) SoloStar NESMÍ být chlazený, ale měl by být uchováván při teplotě do 25 ° C od přímého tepla a světla. Otevřený (v provozu) SoloStar udržovaný při pokojové teplotě musí být po 28 dnech zlikvidován.
Infúzní sady:
Infuzní sady (zásobníky, hadičky a katétry) a Apidra v rezervoáru by měly být zlikvidovány po 48 hodinách používání nebo po vystavení teplotám, které přesahují 37 ° C.
Intravenózní použití:
Infuzní vaky připravené způsobem uvedeným níže DÁVKOVÁNÍ A PODÁNÍ jsou stabilní při pokojové teplotě po dobu 48 hodin.
Příprava a manipulace
Po naředění pro intravenózní použití by měl být roztok před podáním vizuálně zkontrolován na přítomnost částic a změnu zbarvení. Nepoužívejte roztok, pokud zakalil nebo obsahuje částice; použijte, pouze pokud je čirý a bezbarvý. Apidra není kompatibilní s roztokem dextrózy a Ringersovým roztokem, a proto jej nelze použít s těmito tekutinami. Použití Apidry s jinými roztoky nebylo studováno, a proto se nedoporučuje.
Cartridge systém: Pokud OptiClik® (Insulin Delivery Device for Apidra) nefunguje správně, Apidra může být natažena ze systému cartridge do stříkačky U-100 a injikována.
Apidra, inzulín glusin, informace o pacientech (v prosté angličtině)
poslední aktualizace: 02/2009
Podrobné informace o příznacích, příznacích, příčinách, léčbě cukrovky
Účelem informací v této monografii není pokrýt všechna možná použití, pokyny, preventivní opatření, lékové interakce nebo nepříznivé účinky. Tyto informace jsou zobecněné a neslouží jako zvláštní lékařská pomoc. Máte-li dotazy týkající se léků, které užíváte, nebo byste chtěli získat více informací, obraťte se na svého lékaře, lékárníka nebo zdravotní sestru.
zpět k: Procházet všechny léky na cukrovku



