Starlix pro léčbu cukrovky
Název značky: Starlix
Obecný název: nateglinidové tablety
Obsah:
Popis
Klinická farmakologie
Klinické studie
Indikace a použití
Kontraindikace
Opatření
Nežádoucí reakce
Předávkování
Dávkování a správa
Jak dodáván
Starlix, nateglinid, úplné informace o pacientech (v prosté angličtině)
Popis
Starlix® (nateglinid) je orální antidiabetikum používané při léčbě diabetes mellitus 2. typu [známé také jako diabetes mellitus nezávislý na inzulínu (NIDDM) nebo diabetes začínající u dospělých]. Starlix, (-) - N - [(trans-4-isopropylcyklohexan) karbonyl] -D-fenylalanin, strukturálně nesouvisí s perorálními sekretagogy sulfonylmočoviny pro inzulín.
Strukturální vzorec je znázorněn
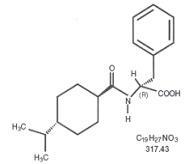
Nateglinid je bílý prášek s molekulovou hmotností 317,43. Je volně rozpustný v methanolu, ethanolu a chloroformu, rozpustný v etheru, málo rozpustný v acetonitrilu a oktanolu a prakticky nerozpustný ve vodě. Tablety Starlixu bikonvexní obsahují 60 mg nebo 120 mg nateglinidu k perorálnímu podání.
Neaktivní složky: koloidní oxid křemičitý, sodná sůl kroskarmelosy, hydroxypropylmethylcelulóza, oxidy železa (červené nebo žlutá), monohydrát laktózy, stearát hořečnatý, mikrokrystalická celulóza, polyethylenglykol, povidon, talek a titan oxid.
horní
Klinická farmakologie
Mechanismus účinku
Nateglinid je derivát aminokyseliny, který snižuje hladinu glukózy v krvi stimulací sekrece inzulínu z pankreatu. Tato akce je závislá na fungování beta-buněk v pankreatických ostrůvcích. Nateglinid interaguje s draslíkovým kanálem citlivým na ATP (K + ATP) na pankreatických beta buňkách. Následná depolarizace beta buňky otevírá vápníkový kanál, což vede k přítoku vápníku a vylučování inzulínu. Rozsah uvolňování inzulínu je závislý na glukóze a snižuje se při nízkých hladinách glukózy. Nateglinid je vysoce tkáňově selektivní s nízkou afinitou pro srdeční a kosterní sval.
Farmakokinetika
Vstřebávání
Po perorálním podání bezprostředně před jídlem se nateglinid rychle vstřebává a střední maximální koncentrace léku v plazmě (Cmax) se obvykle vyskytují do 1 hodiny (Tmax) po podání. Při podávání pacientům s diabetem typu 2 v dávkovém rozmezí 60 mg až 240 mg třikrát denně po dobu jednoho týden, nateglinid prokázal lineární farmakokinetiku pro AUC (plocha pod křivkou závislosti koncentrace na čase / plazmě) a Cmax. Bylo také zjištěno, že Tmax je v této populaci pacientů nezávislá na dávce. Absolutní biologická dostupnost se odhaduje na přibližně 73%. Při podávání s jídlem nebo po jídle zůstává rozsah absorpce nateglinidu (AUC) nedotčen. Existuje však zpoždění v rychlosti absorpce charakterizované poklesem Cmax a zpožděním času do dosažení maximální plazmatické koncentrace (Tmax). Plazmové profily jsou charakterizovány více vrcholy plazmatické koncentrace, když je nateglinid podáván za podmínek nalačno. Tento účinek je snížen, pokud je nateglinid užíván před jídlem.
Rozdělení
Na základě údajů po intravenózním (IV) podání nateglinidu se odhaduje distribuční objem nateglinidu v rovnovážném stavu u zdravých jedinců přibližně 10 litrů. Nateglinid je značně vázán (98%) na sérové proteiny, především na sérový albumin, a v menší míře ± 1 kyselý glykoprotein. Rozsah vazby na sérové proteiny je nezávislý na koncentraci léčiva v testovacím rozmezí 0,1 až 10 ug / ml.
Metabolismus
Nateglinid je před eliminací metabolizován oxidázovým systémem se smíšenou funkcí. Hlavní cesty metabolismu jsou hydroxylace následovaná konjugací glukuronidů. Hlavní metabolity jsou méně účinnými antidiabetiky než nateglinid. Izoprenový minoritní metabolit má účinnost podobnou jako mateřská sloučenina nateglinid.
Údaje in vitro ukazují, že nateglinid je převážně metabolizován izoenzymy cytochromu P450 CYP2C9 (70%) a CYP3A4 (30%).
Vylučování
Nateglinid a jeho metabolity se po perorálním podání rychle a úplně eliminují. Během 6 hodin po podání bylo přibližně 75% podaného 14C-nateglinidu izolováno v moči. Osmdesát tři procent 14C-nateglinidu bylo vyloučeno močí a dalších 10% bylo vyloučeno stolicí. Přibližně 16% 14C-nateglinidu bylo vyloučeno močí jako výchozí látka. Ve všech studiích se zdravými dobrovolníky a pacienty s diabetem 2. typu plazmatické koncentrace nateglinidu rychle klesaly s průměrným poločasem eliminace přibližně 1,5 hodiny. V souladu s tímto krátkým eliminačním poločasem nedošlo k žádné zjevné akumulaci nateglinidu po opakovaném podávání až 240 mg třikrát denně po dobu 7 dnů.
Lékové interakce
Studie metabolismu léčiv in vitro ukazují, že Starlix je převážně metabolizován izoenzymem CYP2C9 cytochromu P450 (70%) a v menší míře CYP3A4 (30%). Starlix je potenciálním inhibitorem izoenzymu CYP2C9 in vivo, jak ukazuje jeho schopnost inhibovat metabolismus tolbutamidu in vitro. In vitro inhibice metabolických reakcí CYP3A4 nebyla detekována.
Glyburid: V randomizované křížové studii s opakovanými dávkami byli pacienti s diabetem 2. typu podávané 120 mg Starlixu třikrát denně před jídlem po dobu 1 dne v kombinaci s glyburidem 10 mg denně. Ve farmakokinetice žádné látky nedošlo k žádným klinicky významným změnám.
Metformin: Když byl Starlix 120 mg třikrát denně před jídlem podáván v kombinaci s metforminem 500 mg tři dvakrát denně u pacientů s diabetem 2. typu nedošlo k žádným klinicky významným změnám ve farmakokinetice činidlo.
Digoxin: Když byl Starlix 120 mg před jídlem podáván v kombinaci s jednorázovou dávkou 1 mg digoxin zdravým dobrovolníkům, nedošlo ani ke klinicky významným změnám ve farmakokinetice činidlo.
Warfarin: Když byl zdravým subjektům podáván Starlix 120 mg třikrát denně před jídlem po dobu čtyř dnů v roce 2006 v kombinaci s jednou dávkou warfarinu 30 mg ve 2. dni nedošlo k žádným změnám ve farmakokinetice činidlo. Protrombinový čas nebyl ovlivněn.
Diclofenac: Podávání ranních a obědových dávek Starlix 120 mg v kombinaci s jednou 75 mg dávka diklofenaku u zdravých dobrovolníků nevedla k žádným významným změnám ve farmakokinetice ani jednoho činidlo.
Zvláštní populace
Geriatrie: Věk neovlivnil farmakokinetické vlastnosti nateglinidu. U starších pacientů proto není nutná úprava dávky.
Pohlaví: Nebyly pozorovány žádné klinicky významné rozdíly ve farmakokinetice nateglinidu mezi muži a ženami. Proto není nutná úprava dávky na základě pohlaví.
Rasa: Výsledky populační farmakokinetické analýzy zahrnující subjekty bělošského, černého a jiného etnického původu naznačují, že rasa má malý vliv na farmakokinetiku nateglinidu.
Poškození ledvin: Ve srovnání se zdravými pacienty s diabetes mellitus 2. typu a středně závažná až těžká renální insuficience (CrCl 15-50 ml / min) ne na dialýze vykazovala podobné zjevné clearance, AUC a Cmax. Pacienti s diabetem 2. typu a renálním selháním na dialýze vykazovali sníženou celkovou expozici léčivu. U hemodialyzačních pacientů však došlo také ke snížení vazby na plazmatické proteiny ve srovnání se zdravými dobrovolníky.
Poškození jater: Vrchol a celková expozice nateglinidu u nediabetických jedinců s mírnou jaterní nedostatečností byly zvýšeny o 30% ve srovnání se zdravými jedinci. Starlix® (nateglinid) by měl být používán s opatrností u pacientů s chronickým onemocněním jater. (Viz OPATŘENÍ, Porucha funkce jater.)
Farmakodynamika
Starlix se rychle vstřebává a stimuluje sekreci inzulínu pankreatu do 20 minut po perorálním podání. Když je dávkována Starlix třikrát denně před jídlem, dochází k rychlému vzestupu plazmatického inzulínu, s maximálními hladinami přibližně 1 hodinu po podání a poklesem na základní hodnotu 4 hodiny po podání.
Ve dvojitě zaslepené, kontrolované klinické studii, ve které byl Starlix podáván před každým ze tří jídla, hladiny glukózy v plazmě byly stanoveny během 12 hodin denně po 7 týdnech léčba. Starlix byl podáván 10 minut před jídlem. Jídla byla založena na standardních nabídkách pro udržování hmotnosti diabetiků s celkovým kalorickým obsahem na základě výšky každého subjektu. Starlix způsobil statisticky významné snížení glykémie nalačno a postprandiální ve srovnání s placebem.
horní
Klinické studie
Celkem 9 566 pacientů bylo randomizováno do devíti dvojitě zaslepených, placebem nebo aktivně kontrolovaných studií po dobu 8 až 24 týdnů, aby se vyhodnotila bezpečnost a účinnost Starlixu (nateglinid). 3 513 pacientů mělo hodnoty účinnosti nad výchozí hodnotu. V těchto studiích byl Starlix podáván až 30 minut před každým ze tří hlavních jídel denně.
Monoterapie Starlix® ve srovnání s placebem
V randomizované, dvojitě zaslepené, placebem kontrolované, 24-týdenní studii, pacienti s diabetem 2. typu s HbA1C ¥ ‰ ¥ 6,8% při dietě samotné byly randomizovány, aby dostávaly buď Starlix (60 mg nebo 120 mg třikrát denně před jídlem), nebo placebo. Výchozí hodnota HbA1C se pohybovala od 7,9% do 8,1% a 77,8% pacientů nebylo dříve léčeno perorální antidiabetickou terapií. U pacientů dříve léčených antidiabetiky bylo požadováno, aby léčbu přerušili alespoň 2 měsíce před randomizací. Přidání Starlixu před jídlem mělo ve srovnání s placebem statisticky významné snížení průměrné HbA1C a průměrné plazmatické glukózy nalačno (FPG) (viz tabulka 1). Snížení HbA1C a FPG bylo podobné u pacientů, kteří dosud nebyli léčeni antidiabetiky, a ti, kteří byli dříve vystaveni antidiabetikům.
V této studii byla u pacienta léčeného přípravkem Starlix 120 mg třikrát denně před jídlem hlášena jedna epizoda těžké hypoglykémie (plazmatická glukóza <36 mg / dl). Žádný pacient nezažil hypoglykémii, která vyžadovala pomoc třetí strany. Pacienti léčení Starlixem měli statisticky významné průměrné zvýšení hmotnosti ve srovnání s placebem (viz tabulka 1).
V další randomizované, dvojitě slepé, 24-týdenní, aktivní a placebem kontrolované studii byli pacienti s diabetem 2. typu randomizováni, aby dostávali Starlix (120 mg třikrát) denně před jídlem), 500 mg metforminu (třikrát denně), kombinace Starlixu 120 mg (třikrát denně před jídlem) a 500 mg metforminu (třikrát denně), nebo placebo. Výchozí hodnota HbA1C se pohybovala od 8,3% do 8,4%. Padesát sedm procent pacientů nebylo dříve léčeno perorální antidiabetickou terapií. Monoterapie Starlixem měla za následek významné snížení průměrné HbA1C a průměrné FPG ve srovnání s placebem, které byly podobné výsledkům studie uvedené výše (viz tabulka 2).
Tabulka 1: Výsledky koncového bodu pro 24týdenní studii s pevnou dávkou monoterapie Starlix®
|
Placebo |
Starlix® 60 mg třikrát denně před jídlem |
Starlix® 120 mg třikrát denně před jídlem |
|
| HbA1C (%) | N = 168 | N = 167 | N = 168 |
| Základní hodnota (průměr) | 8.0 | 7.9 | 8.1 |
| Změna ze základní hodnoty (průměr) | +0.2 | -0.3 | -0.5 |
| Rozdíl oproti placebu (průměr) | -0.5 A | -0.7 A | |
| FPG (mg / dl) | N = 172 | N = 171 | N = 169 |
| Základní hodnota (průměr) | 167.9 | 161.0 | 166.5 |
| Změna ze základní hodnoty (průměr) | +9.1 | +0.4 | -4.5 |
| Rozdíl oproti placebu (průměr) | -8.7 A | -13.6 A | |
| váha (kg) | N = 170 | N = 169 | N = 166 |
| Základní hodnota (průměr) | 85.8 | 83.7 | 86.3 |
| Změna ze základní hodnoty (průměr) | -0.7 | +0.3 | +0.9 |
| Rozdíl oproti placebu (průměr) | +1.0 A | +1.6 A |
p-hodnota 0,004
Monoterapie Starlix® ve srovnání s jinými perorálními antidiabetiky
Glyburid
Ve 24týdenní, dvojitě zaslepené, aktivně kontrolované studii byli pacienti s diabetem typu 2, kteří byli na sulfonylmočovině po dobu 3 měsíců a kteří měl výchozí hladinu HbA1C ¥ ‰ 6,5%, byli randomizováni, aby dostávali Starlix (60 mg nebo 120 mg třikrát denně před jídlem) nebo glyburid 10 mg jednou denně. U pacientů randomizovaných do skupiny Starlix došlo k významnému zvýšení průměrného HbA1C a průměrného FPG v koncovém bodě ve srovnání s pacienty randomizovanými na glyburid.
Metformin
V další randomizované, dvojitě slepé, 24-týdenní, aktivní a placebem kontrolované studii byli pacienti s diabetem 2. typu randomizováni, aby dostávali Starlix (120 mg třikrát) denně před jídlem), 500 mg metforminu (třikrát denně), kombinace Starlixu 120 mg (třikrát denně před jídlem) a 500 mg metforminu (třikrát denně), nebo placebo. Výchozí hodnota HbA1C se pohybovala od 8,3% do 8,4%. Padesát sedm procent pacientů nebylo dříve léčeno perorální antidiabetickou terapií. Snížení průměrného HbA1C a průměrného FPG v koncovém bodě při monoterapii metforminem bylo významně větší než snížení těchto proměnných při monoterapii Starlixem (viz tabulka 2). Ve srovnání s placebem byla monoterapie Starlixem spojena s významným zvýšením průměrné hmotnosti, zatímco monoterapie metforminem byla spojena s významným poklesem průměrné hmotnosti. Mezi podskupinou pacientů dosud neléčících na antidiabetickou terapii bylo snížení průměrné HbA1C a průměrné FPG pro monoterapii Starlixem podobné snížení pro monoterapii metforminem (viz tabulka 2). Mezi podskupinou pacientů dříve léčených jinými antidiabetiky, především glyburidem, HbA1C ve Starlixu skupina monoterapie mírně vzrostla od výchozí hodnoty, zatímco HbA1C byl snížen ve skupině s monoterapií metforminem (viz tabulka 1) 2).
Kombinovaná terapie Starlix®
Metformin
V další randomizované, dvojitě slepé, 24-týdenní, aktivní a placebem kontrolované studii byli pacienti s diabetem 2. typu randomizováni, aby dostávali Starlix (120 mg třikrát) denně před jídlem), 500 mg metforminu (třikrát denně), kombinace Starlixu 120 mg (třikrát denně před jídlem) a 500 mg metforminu (třikrát denně), nebo placebo. Výchozí hodnota HbA1C se pohybovala od 8,3% do 8,4%. Padesát sedm procent pacientů nebylo dříve léčeno perorální antidiabetickou terapií. U pacientů dříve léčených antidiabetiky bylo požadováno, aby léčbu přerušili alespoň 2 měsíce před randomizací. Kombinace Starlixu a metforminu vedla ke statisticky významně většímu snížení HbA1C a FPG ve srovnání s monoterapií Starlixem nebo metforminem (viz tabulka 2). Starlix, samotný nebo v kombinaci s metforminem, ve srovnání s placebem a samotným metforminem významně snížil prandiální zvýšení glukózy z před jídlem na 2 hodiny po jídle.
V této studii byla u pacienta dostávajícího jednu epizodu těžké hypoglykémie (plazmatická glukóza - 36 mg / dl) hlášena Kombinace Starlixu a metforminu a čtyři epizody těžké hypoglykémie byly hlášeny u jednoho pacienta v metforminu rameno léčby. Žádný pacient nezažil epizodu hypoglykémie, která vyžadovala pomoc třetí strany. Ve srovnání s placebem byla monoterapie Starlixem spojena se statisticky významným nárůstem hmotnosti, zatímco u kombinované terapie Starlixem a metforminem nebyla pozorována žádná významná změna hmotnosti (viz tabulka 2).
V další 24týdenní, dvojitě zaslepené, placebem kontrolované studii byli poprvé zařazeni pacienti s diabetem 2. typu s HbA1C C ¥ 6,8% po léčbě metforminem (¥ 1500 mg denně po dobu 1 měsíce) do čtyřtýdenního období záběhu monoterapie metforminem (2 000 mg denně) a poté randomizováno k podávání přípravku Starlix (60 mg nebo 120 mg třikrát denně před jídlem) nebo placeba kromě metforminu. Kombinovaná léčba Starlixem a metforminem byla spojena se statisticky významně větším snížením HbA1C ve srovnání s monoterapií metforminem (-0,4% a -0,6% pro Starlix 60 mg a Starlix 120 mg plus metformin, ).
Tabulka 2: Výsledky koncového bodu pro 24týdenní studii Starlix®monoterapie a kombinace s metforminem
|
Placebo |
Starlix® 120 mg třikrát denně dříve jídla |
Metformin 500 mg třikrát denně |
Starlix® 120 mg před jídla plus Metformin * |
|
| HbA1C (%) | ||||
| Všechno | N = 160 | N = 171 | N = 172 | N = 162 |
| Základní hodnota (průměr) | 8.3 | 8.3 | 8.4 | 8.4 |
| Změna ze základní hodnoty (průměr) | +0.4 | -0.4 před naším letopočtem | -0.8 C | -1.5 |
| Rozdíl oproti placebu | -0.8 A | -1.2 A | -1.9 A | |
| NaÑ-ve | N = 98 | N = 99 | N = 98 | N = 81 |
| Základní hodnota (průměr) | 8.2 | 8.1 | 8.3 | 8.2 |
| Změna ze základní hodnoty (průměr) | +0.3 | -0.7 C | -0.8 C | -1.6 |
| Rozdíl oproti placebu | -1.0 A | -1.1 A | -1.9 A | |
| Non-NaÑ ve | N = 62 | N = 72 | N = 74 | N = 81 |
| Základní hodnota (průměr) | 8.3 | 8.5 | 8.7 | 8.7 |
| Změna ze základní hodnoty (průměr) | +0.6 | +0.004 před naším letopočtem | -0.8 C | -1.4 |
| Rozdíl oproti placebu | -0.6 A | -1.4 A | -2.0 A | |
| FPG (mg / dl) | ||||
| Všechno | N = 166 | N = 173 | N = 174 | N = 167 |
| Základní hodnota (průměr) | 194.0 | 196.5 | 196.0 | 197.7 |
| Změna ze základní hodnoty (průměr) | +8.0 | -13.1 před naším letopočtem | -30.0 C | -44.9 |
| Rozdíl oproti placebu | -21.1 A | -38.0 A | -52.9 A | |
| váha (kg) | ||||
| Všechno | N = 160 | N = 169 | N = 169 | N = 160 |
| Základní hodnota (průměr) | 85.0 | 85.0 | 86.0 | 87.4 |
| Změna ze základní hodnoty (průměr) | -0.4 | +0.9 před naším letopočtem | -0.1 | +0.2 |
| Rozdíl oproti placebu | +1.3 A | +0.3 | +0.6 |
p-hodnota ¤ 0,05 vs. vs. placebo
b p-hodnota ¤ ‰ ¤ 0,03 vs. metformin
c p-hodnota ¤ 0,05 vs. vs. kombinace
* Metformin byl podáván třikrát denně
Rosiglitazon
U pacientů s typem 2 byla provedena 24týdenní, dvojitě zaslepená multicentrická, placebem kontrolovaná studie diabetes není adekvátně kontrolován po terapeutické odpovědi na monoterapii rosiglitazonem 8 mg denně. Přidání přípravku Starlix (120 mg třikrát denně s jídlem) bylo spojeno se statisticky významně větším snížením HbA1C ve srovnání s monoterapií rosiglitazonem. Rozdíl byl -0,77% po 24 týdnech. Průměrná změna hmotnosti oproti výchozím hodnotám byla asi +3 kg u pacientů léčených Starlixem plus rosiglitazonem vs asi +1 kg u pacientů léčených placebem plus rosiglitazonem.
Glyburid
Ve 12týdenní studii u pacientů s diabetem 2. typu nedostatečně kontrolovaných glyburidem 10 mg jednou denně, přidání Starlixu (60 mg nebo 120 mg třikrát denně před jídlem) nepřineslo žádné další výhoda.
horní
Indikace a použití
Starlix® (nateglinid) je indikován jako doplněk stravy a cvičení ke zlepšení kontroly glykémie u dospělých s diabetes mellitus 2. typu.
horní
Kontraindikace
Starlix® (nateglinid) je kontraindikován u pacientů s:
1. Známá přecitlivělost na lék nebo jeho neaktivní složky.
2. Diabetes typu 1.
3. Diabetická ketoacidóza. Tento stav by měl být léčen inzulínem.
horní
Opatření
Makrovaskulární výsledky: Nebyly provedeny žádné klinické studie prokazující přesvědčivé důkazy o snížení makrovaskulárního rizika u přípravku Starlix nebo jakéhokoli jiného antidiabetika.
Hypoglykémie: Všechna orální léčiva snižující hladinu glukózy v krvi, která jsou absorbována systémově, jsou schopna vyvolat hypoglykémii. Frekvence hypoglykémie souvisí s vážností diabetu, úrovní kontroly glykémie a dalšími charakteristikami pacienta. Geriatričtí pacienti, podvyživení pacienti a pacienti s nedostatečností nadledvinek nebo hypofýzy nebo se závažnou poruchou funkce ledvin jsou více náchylní k účinku glukózy na snížení těchto léčebných postupů. Riziko hypoglykémie může být zvýšeno namáhavým pohybem, požitím alkoholu, nedostatečný kalorický příjem na akutním nebo chronickém základě nebo kombinace s jinými perorálními antidiabetiky agenti. U pacientů s autonomní neuropatií a / nebo u pacientů, kteří používají beta-blokátory, může být obtížné rozpoznat hypoglykémii. Starlix® (nateglinid) by měl být podáván před jídlem, aby se snížilo riziko hypoglykémie. Pacienti, kteří vynechávají jídlo, by také měli přeskočit plánovanou dávku přípravku Starlix, aby se snížilo riziko hypoglykémie.
Poškození jater: Starlix by měl být používán s opatrností u pacientů se středně těžkým až těžkým onemocněním jater, protože tito pacienti nebyli studováni.
Ztráta glykemické kontroly
Přechodná ztráta glykemické kontroly se může objevit při horečce, infekci, traumatu nebo chirurgickém zákroku. V takových časech může být místo léčby Starlixem nutná inzulínová terapie. Může se vyskytnout sekundární selhání nebo snížená účinnost Starlixu po určitou dobu.
Informace pro pacienty
Pacienti by měli být informováni o možných rizicích a přínosech přípravku Starlix ao alternativních způsobech léčby. Je třeba vysvětlit rizika a řízení hypoglykémie. Pacienti by měli být poučeni, aby si užili Starlix 1 až 30 minut před užitím jídla, ale pokud přeskočí jídlo, měli by přeskočit svou plánovanou dávku, aby se snížilo riziko hypoglykémie. Lékové interakce by měly být prodiskutovány s pacienty. Pacienti by měli být informováni o potenciálních lékových interakcích s přípravkem Starlix.
Laboratorní testy
Reakce na terapie by měla být pravidelně hodnocena pomocí hodnot glukózy a hladin HbA1C.
Lékové interakce
Nateglinid se vysoce váže na plazmatické proteiny (98%), zejména na albumin. Studie vytěsňování in vitro s léčivy s vysokou vazbou na proteiny, jako je furosemid, propranolol, kaptopril, nikaripin, pravastatin, glyburid, warfarin, fenytoin, kyselina acetylsalicylová, tolbutamid a metformin nevykazovaly žádný vliv na rozsah nateglinidového proteinu vazba. Podobně nateglinid neměl in vitro vliv na vazbu propranololu, glyburidu, nikaripinu, warfarinu, fenytoinu, kyseliny acetylsalicylové a tolbutamidu na sérovou bílkovinu. V klinickém prostředí je však třeba obezřetné vyhodnocení jednotlivých případů.
Některá léčiva, včetně nesteroidních protizánětlivých látek (NSAID), salicylátů, inhibitorů monoamin oxidázy a neselektivní beta-adrenergní blokátory mohou zesílit hypoglykemické působení Starlixu a jiných perorálních antidiabetik drogy.
Některé léky včetně thiazidů, kortikosteroidů, štítných žláz a sympatomimetik mohou snižovat hypoglykemický účinek Starlixu a jiných perorálních antidiabetik.
Pokud se tyto léky podávají pacientům, kteří dostávají Starlix, nebo je z nich vysazují, je třeba pacienta pečlivě sledovat na změny v glykemické kontrole.
Interakce lék / jídlo
Farmakokinetika nateglinidu nebyla ovlivněna složení jídla (vysoký obsah bílkovin, tuků nebo uhlohydrátů). Vrcholové hladiny v plazmě však byly významně sníženy, když byl Starlix podán 10 minut před tekutým jídlem. Starlix neměl žádný vliv na vyprazdňování žaludku u zdravých jedinců, jak bylo stanoveno testováním na acetaminofeny.
Karcinogeneze / mutageneze / zhoršení plodnosti
Karcinogenita: Byla provedena dvouletá studie karcinogenity u potkanů Sprague-Dawley s perorálními dávkami nateglinidu až do 900 mg / kg / den, což vyvolalo expozici AUC. u samců a samic potkanů přibližně 30krát a 40krát vyšší než terapeutická expozice u člověka, s doporučenou dávkou Starlix 120 mg, třikrát denně před jídla. Byla provedena dvouletá studie karcinogenity u myší B6C3F1 s perorálními dávkami nateglinidu až do 400 mg / kg / den, což vyvolalo expozici AUC u mužů a samice myší přibližně 10 a 30krát vyšší než terapeutická expozice u člověka s doporučenou dávkou Starlix 120 mg, třikrát denně před jídlem. U potkanů ani myší nebyl nalezen žádný důkaz tumorigenní odpovědi.
Mutageneze: Nateglinid nebyl genotoxický v in vitro Amesově testu, testu na myších lymfomech, chromozomálních aberacích v plicních buňkách čínského křečka ani v in vivo testu na mikronukleu myší.
Snížení plodnosti: Plodnost nebyla ovlivněna podáním nateglinidu potkanům v dávkách do 600 mg / kg. (přibližně 16násobek terapeutické expozice člověka s doporučenou dávkou Starlix 120 mg třikrát denně dříve) jídla).
Těhotenství
Kategorie těhotenství C
Nateglinid nebyl teratogenní u potkanů v dávkách do 1 000 mg / kg (přibližně 60krát vyšší než terapeutická expozice u člověka při doporučené dávce Starlix 120 mg, třikrát denně před jídlem). U králíků byl embryonální vývoj nepříznivě ovlivněn a výskyt ageneze žlučníku nebo malého žlučníku byl zvýšen dávka 500 mg / kg (přibližně 40násobek terapeutické expozice člověka s doporučenou dávkou Starlix 120 mg, třikrát denně před jídla). Neexistují dostatečné a dobře kontrolované studie u těhotných žen. Starlix by se neměl používat během těhotenství.
Práce a dodávky
Účinek Starlixu na porodu a porod u lidí není znám.
Kojící matky
Studie na laktujících potkanech ukázaly, že nateglinid je vylučován do mléka; poměr AUC0-48h v mléce k plazmě byl přibližně 1: 4. Během peri- a postnatálního období byla tělesná hmotnost nižší u potomků potkanů, kterým byl podán nateglinid v dávce 1 000 mg / kg. (přibližně 60násobek terapeutické expozice člověka s doporučenou dávkou Starlix 120 mg, třikrát denně dříve) jídla). Není známo, zda se Starlix vylučuje do mateřského mléka. Protože se mnoho léků vylučuje do mateřského mléka, neměla by se Starlix podávat kojící ženě.
Pediatrické použití
Bezpečnost a účinnost přípravku Starlix u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Mezi pacienty ve věku 65 let a staršími a pacienty mladšími 65 let nebyly pozorovány žádné rozdíly v bezpečnosti nebo účinnosti přípravku Starlix. Nelze však vyloučit větší citlivost některých starších jedinců na terapii Starlixem.
horní
Nežádoucí reakce
V klinických studiích bylo léčeno Starlixem (nateglinid) přibližně 2 600 pacientů s diabetem 2. typu. Z toho přibližně 1 335 pacientů bylo léčeno po dobu 6 měsíců nebo déle a přibližně 190 pacientů po dobu jednoho roku nebo déle.
Hypoglykémie byla ve všech léčebných ramenech klinických studií relativně neobvyklá. Pouze 0,3% pacientů Starlixu ukončilo léčbu kvůli hypoglykémii. Gastrointestinální příznaky, zejména průjem a nevolnost, nebyly u pacientů užívajících kombinaci Starlixu a metforminu častější než u pacientů užívajících samotný metformin. Podobně periferní edém nebyl častější u pacientů užívajících kombinaci Starlixu a rosiglitazonu než u pacientů užívajících samotný rosiglitazon. Následující tabulka uvádí události, které se vyskytly častěji u pacientů Starlixu než u pacientů s placebem v kontrolovaných klinických studiích.
Časté nežádoucí účinky (â ‰ ¥ 2% u pacientů Starlix®) ve studiích Monoterapie Starlix® (% pacientů)
| Placebo | Starlix® | |
| N = 458 | N = 1441 | |
| Preferovaný termín | ||
| Infekce horních cest dýchacích | 8.1 | 10.5 |
| Bolesti zad | 3.7 | 4.0 |
| Příznaky chřipky | 2.6 | 3.6 |
| Závrať | 2.2 | 3.6 |
| Artropatie | 2.2 | 3.3 |
| Průjem | 3.1 | 3.2 |
| Náhodné trauma | 1.7 | 2.9 |
| Bronchitida | 2.6 | 2.7 |
| Kašel | 2.2 | 2.4 |
| Hypoglykémie | 0.4 | 2.4 |
Během postmarketingových zkušeností byly hlášeny vzácné případy reakcí z přecitlivělosti, jako je vyrážka, svědění a kopřivka. Podobně byly hlášeny případy žloutenky, cholestatické hepatitidy a zvýšených jaterních enzymů.
Laboratorní abnormality
Kyselina močová: U pacientů léčených samotným Starlixem, Starlixem v kombinaci s metforminem, samotným metforminem a samotným glyburidem došlo ke zvýšení průměrných hladin kyseliny močové. Odpovídající rozdíly od placeba byly 0,29 mg / dl, 0,45 mg / dl, 0,28 mg / dl a 0,19 mg / dl. Klinický význam těchto nálezů není znám.
horní
Předávkování
V klinické studii u pacientů s diabetem typu 2 byl přípravek Starlix® (nateglinid) podán v roce 2005 zvýšení dávek až na 720 mg denně po dobu 7 dnů a nevyskytly se žádné klinicky významné nežádoucí účinky hlášeno. V klinických studiích nedošlo k předávkování přípravkem Starlix. Předávkování však může mít za následek přehnané snížení hladiny glukózy s vývojem hypoglykemických příznaků. Hypoglykemické příznaky bez ztráty vědomí nebo neurologických nálezů by měly být léčeny perorální glukózou a úpravou dávkování a / nebo stravovacích návyků. Těžké hypoglykemické reakce s kómatou, záchvaty nebo jinými neurologickými příznaky by měly být léčeny intravenózní glukózou. Protože je nateglinid vysoce vázán na proteiny, dialýza není účinným prostředkem k jeho odstranění z krve.
horní
Dávkování a správa
Starlix® (nateglinid) by měl být užíván 1 až 30 minut před jídlem.
Monoterapie a kombinace s metforminem nebo thiazolidindionem
Doporučená počáteční a udržovací dávka Starlixu, samostatně nebo v kombinaci s metforminem nebo thiazolidindionem, je 120 mg třikrát denně před jídlem.
60mg dávka Starlixu, samotná nebo v kombinaci s metforminem nebo thiazolidindionem, může být použita u pacientů, kteří jsou na začátku léčby HbA1C blízko cíle.
Dávkování u geriatrických pacientů
Obvykle není nutná žádná zvláštní úprava dávky. Nelze však vyloučit větší citlivost některých jedinců na terapii Starlixem.
Dávkování při poškození ledvin a jater
U pacientů s mírnou až těžkou renální nedostatečností nebo u pacientů s mírnou jaterní nedostatečností není nutná úprava dávkování. Dávkování pacientů se středně těžkou až těžkou jaterní dysfunkcí nebylo studováno. Proto by měl být Starlix používán s opatrností u pacientů se středně těžkým až těžkým onemocněním jater (viz OPATŘENÍ, Porucha funkce jater).
horní
Jak dodáván
Tablety Starlix® (nateglinid)
60 mg
Růžové kulaté tablety se zkosenými okraji s vyraženým „Starlixem“ na jedné straně a „60“ na straně druhé.
Lahve po 100... NDC 0078-0351-05
120 mg
Žlutá oválná tableta s vyraženým „Starlixem“ na jedné straně a „120“ na straně druhé.
Lahve po 100... NDC 0078-0352-05
Úložný prostor
Skladujte při 25 ° C (77 ° F); dovolené odchylky od 15 oC do 30 oC (59 oF do 86 oF).
Výdej v těsném kontejneru, USP.
T2008-01
REV: ČERVEN 2008
Vyrobeno:
Novartis Pharma Stein AG
Stein, Švýcarsko
Distribuovány:
Novartis Pharmaceuticals Corporation
East Hanover, New Jersey 07936
© Novartis
Poslední aktualizace 07/2008
Starlix, nateglinid, úplné informace o pacientech (v prosté angličtině)
Podrobné informace o příznacích, příznacích, příčinách, léčbě cukrovky
Účelem informací v této monografii není pokrýt všechna možná použití, pokyny, preventivní opatření, lékové interakce nebo nepříznivé účinky. Tyto informace jsou zobecněné a neslouží jako zvláštní lékařská pomoc. Máte-li dotazy týkající se léků, které užíváte, nebo byste chtěli získat více informací, obraťte se na svého lékaře, lékárníka nebo zdravotní sestru.
zpět k: Procházet všechny léky na cukrovku



