Janumet pro léčbu cukrovky
Název značky: Janumet
Obecný název: sitagliptin a metformin hydrochlorid
Obsah:
Indikace a použití
Dávkování a správa
Dávkové formy a síly
Kontraindikace
Varování a bezpečnostní opatření
Nežádoucí reakce
Lékové interakce
Použití ve specifických populacích
Předávkovat
Popis
Farmakologie
Neklinická toxikologie
Klinické studie
Jak dodáván
Informace pro pacienty
Janumet, sitagliptin a metformin hydrochlorid, informace o pacientech (v prosté angličtině)
VAROVÁNÍ: LACTIC ACIDOSIS
Laktátová acidóza je vzácná, ale závažná komplikace, ke které může dojít v důsledku akumulace metforminu. Riziko se zvyšuje s podmínkami, jako je sepse, dehydratace, nadměrný příjem alkoholu, jaterní nedostatečnost, poškození ledvin a akutní kongestivní srdeční selhání.
Počátek je často jemný, doprovázený pouze nespecifickými příznaky, jako je malátnost, myalgie, respirační potíže, zvyšující somnolence a nespecifické břišní potíže. Laboratorní abnormality zahrnují nízké pH, zvýšenou aniontovou mezeru a zvýšenou hladinu laktátu v krvi.
Pokud je podezření na acidózu, Janumet
1 by mělo být přerušeno a pacient okamžitě hospitalizován. [Vidět Varování a bezpečnostní opatření]Indikace a použití
Přípravek Janumet je indikován jako doplněk stravy a cvičení ke zlepšení kontroly glykémie u dospělých s diabetes mellitus 2. typu, je-li vhodná léčba sitagliptinem a metforminem. [Vidět Klinické studie.]
Důležitá omezení použití
Přípravek Janumet by neměly užívat pacienti s diabetem 1. typu nebo k léčbě diabetické ketoacidózy, protože by v těchto podmínkách nebyl účinný.
Přípravek Janumet nebyl studován v kombinaci s inzulínem.
horní
Dávkování a správa
Doporučené dávkování
Dávka antihyperglykemické terapie přípravkem Janumet by měla být individualizována na základě aktuálního režimu pacienta, účinnost a snášenlivost, přičemž nepřekračuje maximální doporučenou denní dávku 100 mg sitagliptinu a 2000 mg metformin. Počáteční kombinovaná terapie nebo udržování kombinované terapie by mělo být individualizováno a ponecháno na uvážení poskytovatele zdravotní péče.
Janumet by měl být obvykle podáván dvakrát denně s jídlem, s postupným zvyšováním dávky, aby se snížily gastrointestinální (GI) nežádoucí účinky způsobené metforminem.
Počáteční dávka přípravku Janumet by měla vycházet z aktuálního režimu pacienta. Přípravek Janumet by měl být podáván dvakrát denně s jídlem. K dispozici jsou následující dávky:
50 mg sitagliptin / 500 mg metformin hydrochlorid
50 mg sitagliptin / 1 000 mg metformin hydrochlorid.
Pacienti nedostatečně kontrolovaní dietou a cvičením sami
Pokud je léčba kombinovanou tabletou obsahující sitagliptin a metformin považována za vhodnou pro pacienta s diabetes mellitus 2. typu nedostatečně kontrolovaná pouze dietou a cvičením, doporučená počáteční dávka je 50 mg sitagliptin / 500 mg metformin hydrochlorid dvakrát denně. Pacienti s nedostatečnou glykemickou kontrolou této dávky mohou být titrováni až do 50 mg sitagliptinu / 1 000 mg metforminhydrochloridu dvakrát denně.
Pacienti nedostatečně kontrolovaní monoterapií metforminem
Pokud je léčba kombinovanou tabletou obsahující sitagliptin a metformin považována za vhodnou pro pacienta nedostatečně kontrolovaného samotným metforminem, doporučená počáteční dávka přípravku Janumet by měla poskytovat sitagliptin podaný jako 50 mg dvakrát denně (celková denní dávka 100 mg) a dávka metforminu již byla přijato. U pacientů užívajících metformin 850 mg dvakrát denně je doporučená počáteční dávka přípravku Janumet 50 mg sitagliptinu / 1 000 mg metformin hydrochloridu dvakrát denně.
Pacienti nedostatečně kontrolovaní monoterapií sitagliptinem
Pokud je léčba kombinovanou tabletou obsahující sitagliptin a metformin považována za nevhodnou pro pacienta při kontrole samotným sitagliptinem je doporučená počáteční dávka přípravku Janumet 50 mg sitagliptinu / 500 mg metformin hydrochloridu dvakrát denně. Pacienti s nedostatečnou kontrolou této dávky mohou být titrováni až do 50 mg sitagliptinu / 1 000 mg metformin hydrochloridu dvakrát denně. Pacienti užívající monoterapii sitagliptinem upravenou o dávku pro renální insuficienci by neměli být převedeni na přípravek Janumet [viz Kontraindikace].
Pacienti přecházející ze současného podávání sitagliptinu a metforminu
U pacientů, kteří přecházejí ze sitagliptinu podávaného společně s metforminem, může být přípravek Janumet zahájen dávkou sitagliptinu a metforminu, který již byl užíván.
Pacienti nedostatečně kontrolovaní duální kombinační terapií kterýmkoli z následujících antihyperglykemických látek: sitagliptinem, metforminem nebo sulfonylmočovinou
Pokud je v tomto případě považována za vhodnou léčba kombinační tabletou obsahující sitagliptin a metformin Při obvyklém nastavení by obvyklá počáteční dávka přípravku Janumet měla poskytnout sitagliptin podávaný v dávce 50 mg dvakrát denně (celkem 100 mg) denní dávka). Při určování počáteční dávky složky metforminu je třeba zvážit hladinu glykemické kontroly pacienta a aktuální dávku (pokud existuje) metforminu. Je třeba zvážit postupné zvyšování dávky, aby se snížily gastrointestinální (GI) vedlejší účinky spojené s metforminem. Pacienti, kteří v současnosti nebo začínají sulfonylmočovinu, mohou vyžadovat nižší dávky sulfonylmočoviny, aby se snížilo riziko hypoglykémie [viz Varování a bezpečnostní opatření].
Nebyly provedeny žádné studie, které by konkrétně zkoumaly bezpečnost a účinnost přípravku Janumet u pacientů dříve léčených jinými perorálními antihyperglykemiky a přešli na přípravek Janumet. Jakákoli změna v terapii diabetu typu 2 by měla být prováděna s opatrností a vhodným monitorováním, protože může dojít ke změnám v glykemické kontrole.
horní
Dávkové formy a síly
- 50 mg / 500 mg tablety jsou světle růžové, potahované tablety ve tvaru tobolky s vyraženým „575“ na jedné straně.
- 50 mg / 1000 mg tablety jsou červené, potahované tablety ve tvaru tobolky s vyraženým „577“ na jedné straně.
horní
Kontraindikace
Janumet (sitagliptin / metformin HCl) je kontraindikován u pacientů s:
- Onemocnění ledvin nebo renální dysfunkce, např. Jak naznačuje hladina kreatininu v séru 1,5 mg / dl [muži], 1,4 mg / dl [ženy] nebo abnormální clearance kreatininu, která může být také důsledkem stavů, jako je kardiovaskulární kolaps (šok), akutní infarkt myokardu a septikémie [vidět Varování a bezpečnostní opatření].
- Akutní nebo chronická metabolická acidóza, včetně diabetické ketoacidózy, s kómou nebo bez ní.
- Anamnéza závažné hypersenzitivní reakce na Janumet nebo sitagliptin (jedna ze složek přípravku Janumet), jako je anafylaxe nebo angioedém. [Vidět Varování a bezpečnostní opatření a Nežádoucí reakce.]
U pacientů podstupujících radiologické studie zahrnující intravaskulární by měl být přípravek Janumet dočasně vysazen podávání jodovaných kontrastních materiálů, protože použití takových produktů může vést k akutní změně ledvin funkce [viz Varování a bezpečnostní opatření].
horní
Varování a bezpečnostní opatření
Laktátová acidóza
Metformin hydrochlorid
Laktátová acidóza je vzácná, ale závažná metabolická komplikace, ke které může dojít v důsledku akumulace metforminu během léčby přípravkem Janumet; pokud k tomu dojde, je fatální přibližně v 50% případů. Laktátová acidóza může také nastat ve spojení s řadou patofyziologických stavů, včetně diabetes mellitus, a vždy, když existuje významná tkáňová hypoperfúze a hypoxémie. Laktátová acidóza je charakterizována zvýšenými hladinami laktátu v krvi (> 5 mmol / l), sníženým pH krve, poruchami elektrolytů se zvýšenou aniontovou mezerou a zvýšeným poměrem laktát / pyruvát. Pokud je metformin implikován jako příčina laktátové acidózy, obecně se zjistí plazmatická hladina metforminu> 5 μg / ml.
Hlášená incidence laktátové acidózy u pacientů, kteří dostávají hydrochlorid metforminu, je velmi nízká (přibližně 0,03 případů / 1 000 pacientských let, s přibližně 0,015 fatálních případů / 1 000) pacient-roky). Ve více než 20 000 pacientských letech expozice metforminu v klinických studiích nebyly hlášeny žádné případy laktátové acidózy. Hlášené případy se vyskytly primárně u diabetických pacientů s významnou renální nedostatečností, včetně intrinsického renálního selhání onemocnění a renální hypoperfúze, často v prostředí mnohočetných souběžných lékařských / chirurgických problémů a mnohočetných souběžných léky. Pacienti s městnavým srdečním selháním vyžadující farmakologickou léčbu, zejména pacienti s nestabilní nebo akutní městnavé srdeční selhání, u nichž existuje riziko hypoperfúze a hypoxémie, je vystaveno zvýšenému riziku laktátu acidóza. Riziko laktátové acidózy se zvyšuje se stupněm renální dysfunkce a věku pacienta. Riziko laktátové acidózy může být proto významně sníženo pravidelným monitorováním renálních funkcí u pacientů užívajících metformin a použitím minimální účinné dávky metforminu. Zejména by léčba starších osob měla být doprovázena pečlivým sledováním renálních funkcí. Léčba metforminem by neměla být zahájena u pacientů ve věku 80 let, pokud není změřena clearance kreatininu ukazuje, že renální funkce není snížena, protože tito pacienti jsou náchylnější k rozvoji laktátové acidózy. Kromě toho by měl být metformin okamžitě zadržen v přítomnosti jakéhokoli stavu spojeného s hypoxémií, dehydratací nebo sepse. Protože zhoršená funkce jater může významně omezit schopnost čistit laktát, u pacientů s klinickým nebo laboratorním důkazem jaterního onemocnění by se nemělo metformin obecně vyhýbat. Pacienti by měli být při užívání metforminu upozorněni na nadměrný příjem alkoholu, ať už akutní nebo chronický, protože alkohol zesiluje účinky metforminhydrochloridu na metabolismus laktátu. Kromě toho by měl být metformin dočasně vysazen před jakoukoli intravaskulární radiokontrastní studií a před jakýmkoli chirurgickým zákrokem [viz Varování a bezpečnostní opatření].
Nástup laktátové acidózy je často jemný a doprovázen pouze nespecifickými příznaky, jako je malátnost, myalgie, respirační potíže, zvyšující somnolence a nespecifické břišní potíže. Mohou být spojeny s podchlazením, hypotenzí a rezistentními bradyarytmiemi s výraznější acidózou. Pacient a lékař pacienta si musí být vědomi možného významu takových příznaků a pacient by měl být poučen, aby okamžitě informoval lékaře, pokud k nim dojde [viz Varování a bezpečnostní opatření]. Metformin by měl být vysazen, dokud nebude situace vyjasněna. Užitečné mohou být elektrolyty v séru, ketony, glukóza v krvi, a pokud je to indikováno, pH v krvi, hladiny laktátu a dokonce i hladiny metforminu v krvi. Jakmile je pacient stabilizován na jakékoli dávkové hladině metforminu, je nepravděpodobné, že by gastrointestinální příznaky, které jsou běžné při zahájení léčby, souvisely s léčivem. Pozdější výskyt gastrointestinálních příznaků může být způsoben laktátovou acidózou nebo jiným závažným onemocněním.
Hladiny žilného plazmatického laktátu nalačno nad horní hranicí normálu, ale nižší než 5 mmol / l u pacientů užívajících metformin nemusí nutně znamenat hrozící mléčné mléko acidóza a lze ji vysvětlit jinými mechanismy, jako je špatně kontrolovaný diabetes nebo obezita, intenzivní fyzická aktivita nebo technické problémy při manipulaci se vzorkem [vidět Varování a bezpečnostní opatření].
U každého diabetického pacienta s podezřením na ketoacidózu (ketonurie a ketonémie) by mělo být podezření na laktátovou acidózu.
Laktátová acidóza je lékařská pohotovost, která musí být léčena v nemocničním zařízení. U pacientů s laktátovou acidózou, kteří užívají metformin, by léčivo mělo být okamžitě přerušeno a okamžitě by měla být zavedena obecná podpůrná opatření. Protože metformin hydrochlorid je dialyzovatelný (s clearance až 170 ml / min při dobré hemodynamice) podmínky), doporučuje se okamžitá hemodialýza pro korekci acidózy a odstranění nahromaděné metformin. Takové řízení často vede k okamžitému zvrácení symptomů a zotavení [viz Kontraindikace; Varování a bezpečnostní opatření].
Porucha funkce jater
Vzhledem k tomu, že zhoršená funkce jater byla spojena s některými případy laktátové acidózy, nemělo by se Janumet obecně u pacientů s klinickým nebo laboratorním důkazem jaterního onemocnění vyhnout.
Posouzení funkce ledvin
Je známo, že metformin a sitagliptin jsou v podstatě vylučovány ledvinami. Riziko hromadění metforminu a laktátové acidózy se zvyšuje se stupněm poškození funkce ledvin. Pacienti s hladinami kreatininu v séru nad horní hranicí normálu by tedy neměli dostávat přípravek Janumet. U starších pacientů by měl být Janumet pečlivě titrován, aby byla stanovena minimální dávka pro odpovídající glykemický účinek, protože stárnutí může být spojeno se sníženou funkcí ledvin. [Vidět Varování a bezpečnostní opatření a Použití ve specifických populacích.]
Před zahájením léčby přípravkem Janumet a nejméně jednou ročně by měla být funkce ledvin vyhodnocena a ověřena jako normální. U pacientů, u nichž se předpokládá vývoj renální dysfunkce, zejména u starších pacientů, ledvin funkce by měla být hodnocena častěji a léčba přípravkem Janumet by měla být přerušena, pokud je prokázána porucha funkce ledvin současnost, dárek.
Vitamin B12 Úrovně
V kontrolovaných klinických studiích s metforminem trvajícím 29 týdnů, pokles na podnormální hladiny dříve normálního sérového vitaminu B12 hladiny, bez klinických projevů, byly pozorovány přibližně u 7% pacientů. Takové snížení, pravděpodobně v důsledku interference s B12 absorpce z B12-intrinický faktorový faktor je však velmi zřídka spojen s anémií a zdá se, že je rychle reverzibilní po přerušení podávání metforminu nebo vitamínu B12 doplnění. U pacientů užívajících přípravek Janumet se doporučuje každoročně měřit hematologické parametry a veškeré zjevné abnormality by měly být náležitě vyšetřeny a léčeny. [Vidět Nežádoucí reakce.]
Někteří jedinci (ti s nedostatečným vitamínem B12 nebo příjem nebo absorpce vápníku) se zdá, že jsou náchylné k rozvoji subnormálního vitamínu B12 úrovně. U těchto pacientů rutinní sérový vitamín B12 mohou být užitečná měření ve dvou až tříletých intervalech.
Příjem alkoholu
Je známo, že alkohol zesiluje účinek metforminu na metabolismus laktátu. Pacienti by proto měli být během léčby přípravkem Janumet varováni před nadměrným příjmem alkoholu, akutním nebo chronickým.
Chirurgické postupy
Použití přípravku Janumet by mělo být dočasně přerušeno pro jakýkoli chirurgický zákrok (s výjimkou menších zákroků, které nejsou spojeny s omezeným příjmem) potravin a tekutin) a nemělo by se znovu zahájit, dokud se neobnoví perorální příjem pacienta a dokud se nevyhodnotí funkce ledvin normální.
Změna klinického stavu pacientů s dříve kontrolovanou cukrovkou 2. typu
Pacient s diabetem 2. typu, dříve dobře kontrolovaným přípravkem Janumet, u kterého se vyvinou laboratorní abnormality nebo klinický obraz nemoc (zejména vágní a špatně definovaná nemoc) by měla být neprodleně vyhodnocena z hlediska důkazu ketoacidózy nebo laktátu acidóza. Vyhodnocení by mělo zahrnovat sérové elektrolyty a ketony, glukózu v krvi a, pokud je to uvedeno, pH krve, hladiny laktátu, pyruvátu a metforminu. Pokud dojde k acidóze kterékoli formy, musí být přípravek Janumet okamžitě zastaven a musí být zahájena další vhodná nápravná opatření.
Použití s léky, o nichž je známo, že způsobují hypoglykémii
Sitagliptin
Jak je typické u jiných antihyperglykemických látek používaných v kombinaci se sulfonylmočovinou, byl sitagliptin používán v kombinaci s metforminem a sulfonylmočovina, lék, o kterém je známo, že způsobuje hypoglykémii, byl výskyt hypoglykémie zvýšen oproti placebu v kombinaci s metforminem a sulfonylmočovina [viz Nežádoucí reakce]. Proto pacienti, kteří také dostávají sekretagog inzulinu (např. Sulfonylmočovina, meglitinid), mohou pro snížení rizika hypoglykémie vyžadovat nižší dávku sekretagogu inzulínu [viz Dávkování a správa].
Metformin hydrochlorid
Hypoglykémie se nevyskytuje u pacientů, kteří dostávají metformin samotný za obvyklých okolností použití, ale může nastat, když je kalorický příjem nedostatečný, když namáhavé cvičení není kompenzováno kalorickou suplementací nebo během současného užívání s jinými látkami snižujícími hladinu glukózy (jako jsou sulfonylmočoviny a inzulín) nebo ethanol. Starší, oslabení nebo podvyživení pacienti a pacienti s adrenální nebo hypofyzární nedostatečností nebo intoxikací alkoholem jsou zvláště náchylní k hypoglykemickým účinkům. Hypoglykémie může být obtížné rozpoznat u starších lidí au lidí, kteří užívají léky blokující adrenergie.
Souběžné léky ovlivňující renální funkce nebo dispozice metforminu
Současné léky, které mohou ovlivnit funkci ledvin nebo vést k významné hemodynamické změně nebo mohou interferují s dispozicí metforminu, jako jsou kationtová léčiva, která jsou vylučována renální tubulární sekrecí [vidět Lékové interakce], byste měli používat opatrně.
Radiologické studie s intravaskulárními jódovými kontrastními látkami
Intravaskulární kontrastní studie s jodovanými materiály (například intravenózním urogramem, intravenózní cholangiografií, angiografií a počítačovou tomografií (CT)) s intravaskulárními kontrastními látkami) může vést k akutní změně funkce ledvin a byla u pacientů užívajících metformin spojena s laktátovou acidózou [viz Kontraindikace]. U pacientů, u nichž je taková studie plánována, by proto měl být přípravek Janumet dočasně vysazen v době nebo před zahájením léčby. po 48 hodinách po zákroku a obnoveno až poté, co byla znovu vyhodnocena funkce ledvin a bylo zjištěno, že být normální.
Hypoxické státy
Kardiovaskulární kolaps (šok) z jakékoli příčiny, akutní městnavé srdeční selhání, akutní infarkt myokardu a jiné stavy charakterizované hypoxémií byly spojeny s laktátovou acidózou a mohou také způsobit prerenal azotémie. Pokud k těmto událostem dojde u pacientů léčených přípravkem Janumet, mělo by být léčivo okamžitě přerušeno.
Ztráta kontroly nad hladinou glukózy v krvi
Pokud je pacient stabilizovaný na jakémkoli diabetickém režimu vystaven stresu, jako je horečka, trauma, infekce nebo chirurgický zákrok, může dojít k dočasné ztrátě glykemické kontroly. V takových případech může být nutné Janumet zadržet a dočasně podat inzulín. Po vyřešení akutní epizody může být přípravek Janumet obnoven.
Hypersenzitivní reakce
U pacientů léčených sitagliptinem, jednou ze složek přípravku Janumet, byly zaznamenány postmarketingové zprávy o závažných reakcích z přecitlivělosti. Tyto reakce zahrnují anafylaxi, angioedém a exfoliativní kožní stavy včetně Stevens-Johnsonova syndromu. Protože tyto reakce jsou uváděny dobrovolně z populace nejisté velikosti, je to obecně není možné spolehlivě odhadnout jejich frekvenci ani navázat příčinnou souvislost s expozicí lékům. Nástup těchto reakcí se objevil během prvních 3 měsíců po zahájení léčby sitagliptinem, některé zprávy se objevily po první dávce. Pokud je podezření na hypersenzitivní reakci, přerušte léčbu přípravkem Janumet, zhodnoťte další možné příčiny této události a zahájte alternativní léčbu diabetu. [Vidět Nežádoucí reakce.]
Makrovaskulární výsledky
Nebyly provedeny žádné klinické studie prokazující přesvědčivé důkazy o snížení makrovaskulárního rizika s přípravkem Janumet nebo jiným antidiabetikem.
horní
Nežádoucí reakce
Zkušenosti s klinickými zkouškami
Vzhledem k tomu, že klinická hodnocení jsou prováděna za velmi proměnlivých podmínek, lze v klinických hodnoceních a lék nelze přímo srovnávat s mírami v klinických studiích s jiným lékem a nemusí odrážet míry pozorované v roce 2008 praxe.
Souběžné podávání sitagliptinu a metforminu u pacientů s diabetem typu 2 nedostatečně kontrolovaných dietou a cvičením
Tabulka 1 shrnuje nejčastější (â ‰ ¥ 5% pacientů) hlášené nežádoucí účinky (bez ohledu na hodnocení příčinnosti zkoušejícím) za 24 týdnů placebem kontrolovaná faktoriální studie, ve které byly sitagliptin a metformin podávány současně pacientům s diabetem typu 2 nedostatečně kontrolovaným dietou a cvičení.
Tabulka 1: Sitagliptin a metformin podávané pacientům s diabetem typu 2 nedostatečně kontrolovanými dietou a cvičením: nežádoucí účinky Hlášeno (bez ohledu na hodnocení příčinnosti vyšetřovatelem) u 5% pacientů, kteří dostávali kombinovanou terapii (a vyšší než u pacientů, kteří dostávali kombinovanou terapii) Placebo)*
| Počet pacientů (%) | ||||
Placebo |
Sitagliptin 100 mg QD |
Metformin 500 mg / Metformin 1000 mg bid†|
Sitagliptin 50 mg bid + Metformin 500 mg / Metformin 1000 mg bid†|
|
| N = 176 | N = 179 | N = 364†| N = 372†| |
| ||||
| Průjem | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) |
| Infekce horních cest dýchacích | 9 (5.1) | 8 (4.5) | 19 (5.2) | 23 (6.2) |
| Bolest hlavy | 5 (2.8) | 2 (1.1) | 14 (3.8) | 22 (5.9) |
Doplňková léčba sitagliptinem u pacientů s diabetem typu 2 nedostatečně kontrolovaná na metforminu samotném
Ve 24týdenní placebem kontrolované studii se sitagliptinem 100 mg podávaným jednou denně přidaným do režimu metforminu podávaného dvakrát denně nebyly žádné hlášené nežádoucí účinky bez ohledu na hodnocení příčinnosti vyšetřovatelem u 5% pacientů a častěji než u pacientů, kterým byl podáván placebo. Přerušení léčby z důvodu klinických nežádoucích účinků bylo podobné skupině léčené placebem (sitagliptin a metformin, 1,9%; placebo a metformin, 2,5%).
Hypoglykémie
Nežádoucí účinky hypoglykémie byly založeny na všech hlášeních o hypoglykémii; souběžné měření glukózy nebylo nutné. Celkový výskyt předem určených nežádoucích účinků hypoglykémie u pacientů s diabetem 2. typu nedostatečně kontrolovaných dietou a cvičením byl 0,6% u u pacientů, kterým bylo podáváno placebo, 0,6% u pacientů, kteří dostávali samotný sitagliptin, 0,8% u pacientů, kterým byl podáván samotný metformin, a 1,6% u pacientů, kterým byl podáván sitagliptin v kombinaci s metformin. U pacientů s diabetem 2. typu nedostatečně kontrolovaných samotným metforminem je celkový výskyt nežádoucích účinků reakce hypoglykémie byly 1,3% u pacientů, kterým byl podáván přídavný sitagliptin, a 2,1% u pacientů, kterým byl podáván přídavný sitagliptin placebo.
Gastrointestinální nežádoucí reakce
Výskyt předem vybraných gastrointestinálních nežádoucích účinků u pacientů léčených sitagliptinem a metforminem byl podobný jako u pacientů léčených samotným metforminem. Viz tabulka 2.
Tabulka 2: Předvolené gastrointestinální nežádoucí reakce (bez ohledu na hodnocení příčinnosti vyšetřovatele) hlášené u pacientů s diabetem 2. typu, kteří dostávají sitagliptin a metformin.
| Počet pacientů (%) | ||||||
| Studium sitagliptinu a metforminu u pacientů nedostatečně kontrolovaných na dietu a cvičení |
Studie doplňování sitagliptinu u pacientů nedostatečně kontrolovaných na metforminu samotném | |||||
Placebo |
Sitagliptin 100 mg QD |
Metformin 500 mg / Metformin 1000 mg bid* |
Sitagliptin 50 mg bid + Metformin 500 mg / Metformin 1000 mg bid* |
Placebo a Metformin - 1500 mg denně |
Sitagliptin 100 mg QD a metformin - 1500 mg denně |
|
| N = 176 | N = 179 | N = 364 | N = 372 | N = 237 | N = 464 | |
| ||||||
| Průjem | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) | 6 (2.5) | 11 (2.4) |
| Nevolnost | 2 (1.1) | 2 (1.1) | 20 (5.5) | 18 (4.8) | 2 (0.8) | 6 (1.3) |
| Zvracení | 1 (0.6) | 0 (0.0) | 2 (0.5) | 8 (2.2) | 2 (0.8) | 5 (1.1) |
| Bolest břicha†| 4 (2.3) | 6 (3.4) | 14 (3.8) | 11 (3.0) | 9 (3.8) | 10 (2.2) |
Sitagliptin v kombinaci s metforminem a glimepiridem
Ve 24týdenní placebem kontrolované studii 100 mg sitagliptinu jako přídavné léčby u pacientů s diabetem typu 2 nedostatečně kontrolovaných metforminem a glimepiridem (sitagliptin, N = 116; placebo, N = 113), nežádoucí účinky byly hlášeny bez ohledu na hodnocení příčinné souvislosti u 5% pacientů léčeni sitagliptinem a častěji než u pacientů léčených placebem: hypoglykémie (sitagliptin, 16,4%; placebo, 0,9%) a bolesti hlavy (6,9%, 2,7%).
Při kombinaci sitagliptinu a metforminu nebyly pozorovány žádné klinicky významné změny životních funkcí nebo EKG (včetně QTc intervalu).
Nejčastější nepříznivé zkušenosti s monoterapií sitagliptinem byly hlášeny bez ohledu na zkoušejícího hodnocení kauzality u 5% pacientů a častěji než u pacientů užívajících placebo bylo nasofaryngitida.
Mezi nejčastější (> 5%) zjištěné nežádoucí účinky v důsledku zahájení léčby metforminem patří průjem, nevolnost / zvracení, plynatost, břišní obtíže, poruchy trávení, astenie a bolesti hlavy.
Laboratorní testy
Sitagliptin
Výskyt laboratorních nežádoucích účinků byl podobný u pacientů léčených sitagliptinem a metforminem (7,6%) ve srovnání s pacienty léčenými placebem a metforminem (8,7%). Ve většině, ale ne ve všech studiích, malé zvýšení počtu bílých krvinek (rozdíl přibližně 200 buněk / mikroL ve WBC vs. placebo; průměrná základní hodnota WBC přibližně 6600 buněk / mikroL) byla pozorována v důsledku malého nárůstu neutrofilů. Tato změna laboratorních parametrů se nepovažuje za klinicky relevantní.
Metformin hydrochlorid
V kontrolovaných klinických studiích s metforminem trvajícím 29 týdnů, pokles na podnormální hladiny dříve normálního sérového vitaminu B12 hladiny, bez klinických projevů, byly pozorovány přibližně u 7% pacientů. Takové snížení, pravděpodobně v důsledku interference s B12 absorpce z B12-intrinický faktorový faktor je však velmi zřídka spojen s anémií a zdá se, že je rychle reverzibilní po přerušení podávání metforminu nebo vitamínu B12 doplnění. [Vidět Varování a bezpečnostní opatření.]
Zkušenosti po uvedení na trh
Následující dodatečné nežádoucí účinky byly zjištěny při použití přípravku Janumet nebo sitagliptinu, jedné ze složek přípravku Janumet, po jeho schválení. Protože tyto reakce jsou uváděny dobrovolně z populace nejisté velikosti, je to obecně není možné spolehlivě odhadnout jejich frekvenci ani navázat příčinnou souvislost s expozicí lékům.
Hypersenzitivní reakce zahrnují anafylaxi, angioedém, vyrážku, kopřivku, kožní vaskulitidu a exfoliativní kožní stavy včetně Stevens-Johnsonova syndromu [viz Varování a bezpečnostní opatření]; infekce horních cest dýchacích; zvýšení jaterních enzymů; pankreatitida.
horní
Lékové interakce
Kationtové léky
Kationická léčiva (např. Amilorid, digoxin, morfin, prokainamid, chinidin, chinin, ranitidin, triamteren, trimethoprim nebo vankomycin), které jsou eliminovaný renální tubulární sekrecí má teoreticky potenciál pro interakci s metforminem soutěží o běžný renální tubulární transport systémy. Taková interakce mezi metforminem a perorálním cimetidinem byla pozorována u zdravých dobrovolníků u jednorázové i opakované dávky metformin-cimetidinu studie lékových interakcí se 60% zvýšením maximální koncentrace metforminu v plazmě a plné krvi a 40% zvýšením plazmy a plné krve v metforminu AUC. Ve studii s jednorázovou dávkou nedošlo k žádné změně eliminačního poločasu. Metformin neměl žádný účinek na farmakokinetiku cimetidinu. Přestože takové interakce zůstávají teoretické (s výjimkou cimetidinu), pečlivé sledování pacienta a úprava dávky přípravku Janumet a / nebo přípravku interferující lék se doporučuje u pacientů, kteří užívají kationtové léky, které se vylučují proximální tubulární sekrecí ledvin Systém.
Digoxin
V oblasti pod křivkou došlo k mírnému zvýšení (AUC, 11%) a průměrné maximální koncentraci léčiva (Cmax, 18%) digoxinu při současném podávání 100 mg sitagliptinu po dobu 10 dnů. Tato zvýšení se nepovažují za pravděpodobně klinicky významná. Digoxin jako kationtový lék má potenciál konkurovat metforminu o běžné renální tubulární transportní systémy, což ovlivňuje sérové koncentrace digoxinu, metforminu nebo obou. Pacienti, kteří dostávají digoxin, by měli být náležitě monitorováni. Nedoporučuje se úprava dávkování digoxinu ani přípravku Janumet.
Glyburid
Ve studii interakce s jednou dávkou u pacientů s diabetem 2. typu nemělo současné podávání metforminu a glyburidu žádné změny farmakokinetiky ani farmakodynamiky metforminu. Snížení AUC a C glyburidumax byly pozorovány, ale byly velmi variabilní. Vzhledem k jednorázové povaze této studie a nedostatečné korelaci mezi hladinami glyburidu v krvi a farmakodynamickými účinky je klinický význam této interakce nejistý.
Furosemid
Studie interakce léku s metforminem a furosemidem v jedné dávce u zdravých jedinců prokázala, že při současném podání byly ovlivněny farmakokinetické parametry obou sloučenin. Furosemid zvýšil plazmatickou metformin a krevní Cmax o 22% a AUC v krvi o 15%, bez jakékoli významné změny renální clearance metforminu. Když se podává s metforminem, Cmax a AUC furosemidu byly o 31% a 12% menší, než když byly podávány samostatně, a konečný poločas byl snížen o 32%, aniž by došlo k významné změně renálního furosemidu odbavení. O interakcích metforminu a furosemidu při chronickém současném podávání nejsou k dispozici žádné informace.
Nifedipine
Studie interakce léčiv s metformin-nifedipinem v jedné dávce u zdravých dobrovolníků prokázala, že současné podávání nifedipinu zvýšilo plazmatický metformin Cmax a AUC o 20%, respektive 9%, a zvýšilo množství vylučované močí. Tmax a poločas nebyl ovlivněn. Zdá se, že nifedipin zvyšuje absorpci metforminu. Metformin měl minimální účinky na nifedipin.
Použití metforminu s jinými léky
Některá léčiva mají sklon produkovat hyperglykémii a mohou vést ke ztrátě glykemické kontroly. Mezi tyto léky patří thiazidy a další diuretika, kortikosteroidy, fenothiaziny, produkty štítné žlázy, estrogeny, orální antikoncepční prostředky, fenytoin, kyselina nikotinová, sympatomimetika, léčiva blokující vápníkový kanál a isoniazid. Pokud jsou takováto léčiva podávána pacientovi, který užívá přípravek Janumet, je třeba pacienta pečlivě sledovat, aby byla zachována dostatečná glykemická kontrola.
U zdravých dobrovolníků nebyla farmakokinetika metforminu a propranololu a metforminu a ibuprofenu při současném podávání ve studiích interakce s jednou dávkou ovlivněna.
Metformin je zanedbatelně vázán na plazmatické proteiny, a proto je méně pravděpodobné, že bude interagovat s vysoce vázanými proteiny, jako jsou salicyláty, sulfonamidy, chloramfenikol a probenecid ve srovnání se sulfonylmočovinami, které jsou značně vázány na sérum proteiny.
horní
Použití ve specifických populacích
Těhotenství
Kategorie těhotenství B:
Janumet
Neexistují dostatečné a dobře kontrolované studie u těhotných žen s přípravkem Janumet nebo jeho jednotlivými složkami; Proto není bezpečnost přípravku Janumet u těhotných žen známa. Přípravek Janumet by se měl během těhotenství používat pouze v nezbytných případech.
Merck & Co., Inc. udržuje registr, který sleduje těhotenské výsledky žen vystavených působení Janumetu během těhotenství. Poskytovatelé zdravotní péče se vyzývají, aby nahlásili jakoukoli prenatální expozici přípravku Janumet na tel.
S kombinovanými přípravky v přípravku Janumet nebyly provedeny žádné studie na zvířatech k vyhodnocení účinků na reprodukci. Následující údaje vycházejí ze zjištění ve studiích prováděných samostatně se sitagliptinem nebo metforminem.
Sitagliptin
Reprodukční studie byly provedeny na potkanech a králících. Dávky sitagliptinu až do 125 mg / kg (přibližně 12násobek expozice člověka při maximální doporučené dávce pro člověka) nezhoršily plodnost ani nepoškozovaly plod. Neexistují však žádné adekvátní a dobře kontrolované studie se sitagliptinem u těhotných žen.
Sitagliptin podávaný těhotným samicím potkanů a králíkům od 6. do 20. dne březosti (organogeneze) nebyl teratogenní při perorálních dávkách do 250 mg / kg (potkani) a 125 mg / kg (králíci), nebo přibližně 30 a 20krát expozice člověka při maximální doporučené dávce pro člověka (MRHD) 100 mg / den na základě AUC srovnání. Vyšší dávky zvýšily výskyt malformací žeber u potomků při 1000 mg / kg nebo přibližně 100krát vyšší expozici u lidí při MRHD.
Sitagliptin podávaný samicím potkanů od 6. dne do 21. dne laktace snížil tělesnou hmotnost samců a samic potomstva o 1 000 mg / kg. U potomků potkanů nebyla pozorována žádná funkční nebo behaviorální toxicita.
Placentární přenos sitagliptinu podávaného těhotným potkanům byl přibližně 45% po 2 hodinách a 80% po 24 hodinách po podání dávky. Placentární přenos sitagliptinu podávaného těhotným králíkům byl přibližně 66% za 2 hodiny a 30% za 24 hodin.
Metformin hydrochlorid
Metformin nebyl teratogenní u potkanů a králíků v dávkách až 600 mg / kg / den. To představuje expozici přibližně 2krát a 6krát vyšší než maximální doporučená denní dávka pro člověka 2 000 mg na základě srovnání povrchu těla pro potkany a králíky. Stanovení fetálních koncentrací prokázalo částečnou placentární bariéru metforminu.
Kojící matky
S kombinovanými složkami přípravku Janumet nebyly provedeny žádné studie na laktujících zvířatech. Ve studiích prováděných s jednotlivými složkami se sitagliptin i metformin vylučují do mléka kojících potkanů. Není známo, zda se sitagliptin vylučuje do mateřského mléka. Protože se mnoho léčiv vylučuje do mateřského mléka, je třeba při podávání přípravku Janumet kojící ženě postupovat opatrně.
Pediatrické použití
Bezpečnost a účinnost přípravku Janumet u pediatrických pacientů mladších 18 let nebyla stanovena.
Geriatrické použití
Janumet
Protože sitagliptin a metformin jsou vylučovány ledvinami a protože stárnutí může být spojeno se sníženou funkcí ledvin, měl by být přípravek Janumet používán s rostoucím věkem opatrně. Při výběru dávky je třeba postupovat opatrně a musí být založen na pečlivém a pravidelném sledování renálních funkcí. [Vidět Varování a bezpečnostní opatření; Klinická farmakologie.]
Sitagliptin
Z celkového počtu subjektů (N = 3884) v klinických studiích se sitagliptinem ve fázi II a III bylo 725 pacientů ve věku 65 let a více, zatímco 61 pacientů ve věku 75 let a více. Mezi osobami ve věku 65 let a staršími a mladšími osobami nebyly pozorovány žádné celkové rozdíly v bezpečnosti nebo účinnosti. I když tato a další uváděné klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacienty nemůže být větší citlivost některých starších jedinců vyloučeno.
Metformin hydrochlorid
Kontrolované klinické studie s metforminem nezahrnovaly dostatečný počet starších pacientů, aby bylo možné zjistit, zda reagují odlišně od mladších pacientů, ačkoli jiné uváděné klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacientů. Metformin by měl být používán pouze u pacientů s normální funkcí ledvin. Počáteční a udržovací dávka metforminu by měla být u pacientů s pokročilým věkem konzervativní vzhledem k možnosti snížené funkce ledvin v této populaci. Jakákoli úprava dávky by měla být založena na pečlivém posouzení funkce ledvin. [Vidět Kontraindikace; Varování a bezpečnostní opatření; a Klinická farmakologie.]
horní
Předávkovat
Sitagliptin
Během kontrolovaných klinických studií u zdravých jedinců byly podány jednotlivé dávky až 800 mg sitagliptinu. Maximální průměrné zvýšení QTc o 8,0 ms bylo pozorováno v jedné studii při dávce 800 mg sitagliptinu, což je průměrný účinek, který není považován za klinicky důležitý [viz Klinická farmakologie]. S dávkami nad 800 mg u lidí nejsou žádné zkušenosti. Ve studiích s více dávkami fáze I nebyly pozorovány žádné klinické nežádoucí účinky závislé na dávce se sitagliptinem v dávkách až 400 mg denně po dobu až 28 dnů.
V případě předávkování je rozumné použít obvyklá podpůrná opatření, např. Odstranit neabsorbovaný materiál z gastrointestinálního traktu traktu, využívají klinického sledování (včetně získání elektrokardiogramu) a zavádějí podpůrnou terapii, jak je indikováno klinickou postavení.
Sitagliptin je mírně dialyzovatelný. V klinických studiích bylo přibližně 13,5% dávky odstraněno během 3 až 4 hodinové hemodialyzační relace. Je-li to klinicky vhodné, lze zvážit prodlouženou hemodialýzu. Není známo, zda je sitagliptin dialyzovatelný peritoneální dialýzou.
Metformin hydrochlorid
Došlo k předávkování hydrochloridem metforminu, včetně požití množství větších než 50 gramů. Hypoglykémie byla hlášena přibližně v 10% případů, ale nebyla prokázána žádná příčinná souvislost s hydrochloridem metforminu. Laktátová acidóza byla hlášena přibližně u 32% případů předávkování metforminem [viz Varování a bezpečnostní opatření]. Metformin je dialyzovatelný s clearance až 170 ml / min za dobrých hemodynamických podmínek. Proto může být hemodialýza užitečná pro odstranění nahromaděného léčiva od pacientů, u nichž existuje podezření na předávkování metforminem.
horní
Popis
Tablety Janumet (sitagliptin / metformin HCl) obsahují dvě perorální antihyperglykemická léčiva používaná při léčbě cukrovky typu 2: sitagliptin a metformin hydrochlorid.
Sitagliptin
Sitagliptin je perorálně účinný inhibitor enzymu dipeptidylpeptidáza-4 (DPP-4). Sitagliptin je přítomen v tabletách Janumet ve formě monohydrátu sitagliptin fosfátu. Monohydrát sitagliptin fosfátu je chemicky popisován jako 7 - [(3R) - 3 - amino - 1 - oxo - 4 - (2,4,5 - trifluorfenyl) butyl] - 5,6,7,8 - tetrahydro - 3 - (trifluormethyl) - 1,2,4 - triazolo [4,3 - a] pyrazin fosfát (1: 1) monohydrát s empirickým vzorcem C16H15F6N5ACH3PO4-H2O a molekulová hmotnost 523,32. Strukturální vzorec je:

Monohydrát sitagliptin fosfátu je bílý až téměř bílý krystalický nehygroskopický prášek. Je rozpustný ve vodě a N, N-dimethylformamidu; lehce rozpustný v methanolu; velmi mírně rozpustný v ethanolu, acetonu a acetonitrilu; a nerozpustný v isopropanolu a isopropylacetátu.
Metformin hydrochlorid
Hydrochlorid metforminu (hydrochlorid N, N-dimethylimidodikarbonimidového diamidu) není chemicky ani farmakologicky příbuzný žádné jiné třídě perorálních antihyperglykemických látek. Hydrochlorid metforminu je bílá až téměř bílá krystalická sloučenina s molekulárním vzorcem C4H11N5-HCl a molekulová hmotnost 165,63. Hydrochlorid metforminu je volně rozpustný ve vodě a je prakticky nerozpustný v acetonu, etheru a chloroformu. PKA metforminu je 12,4. Hodnota pH 1% vodného roztoku metformin-hydrochloridu je 6,68. Strukturální vzorec je znázorněn:

Janumet
Přípravek Janumet je k dispozici pro perorální podání ve formě tablet obsahujících 64,25 mg monohydrátu sitagliptin fosfátu a ekvivalentu metformin hydrochloridu do: 50 mg sitagliptinu ve formě volné báze a 500 mg hydrochloridu metforminu (Janumet 50 mg / 500 mg) nebo 1 000 mg metformin hydrochloridu (Janumet 50 mg / 1000 mg). Jedna potahovaná tableta přípravku Janumet obsahuje následující neaktivní složky: mikrokrystalická celulóza, polyvinylpyrrolidon, laurylsulfát sodný a stearylfumarát sodný. Kromě toho filmový potah obsahuje následující neaktivní složky: polyvinylalkohol, polyethylenglykol, talek, oxid titaničitý, červený oxid železitý a černý oxid železitý.
horní
Klinická farmakologie
Mechanismus účinku
Janumet
Přípravek Janumet kombinuje dvě antihyperglykemická činidla s komplementárními mechanismy účinku ke zlepšení kontroly glykémie u pacientů s cukrovka typu 2: sitagliptin, inhibitor dipeptidylpeptidázy-4 (DPP-4), a metformin-hydrochlorid, člen biguanidu třída.
Sitagliptin
Sitagliptin je inhibitor DPP-4, o kterém se předpokládá, že působí u pacientů s diabetem typu 2 zpomalením inaktivace inkretinových hormonů. Koncentrace aktivních intaktních hormonů se zvyšuje sitagliptinem, čímž se zvyšuje a prodlužuje účinek těchto hormonů. Inkretinové hormony, včetně glukagonu podobného peptidu-1 (GLP-1) a glukózy závislé inzulotropní látky polypeptid (GIP), jsou uvolňovány střevem po celý den a hladiny se zvyšují v reakci k jídlu. Tyto hormony jsou rychle inaktivovány enzymem DPP-4. Inkretiny jsou součástí endogenního systému podílejícího se na fyziologické regulaci homeostázy glukózy. Když jsou koncentrace glukózy v krvi normální nebo zvýšené, GLP-1 a GIP zvyšují syntézu inzulínu a uvolňování z beta buněk pankreatu intracelulárními signálními cestami zahrnujícími cyklický AMP. GLP-1 také snižuje sekreci glukagonu z alfa buněk pankreatu, což vede ke snížené produkci glukózy v játrech. Zvýšením a prodloužením hladin aktivního inkretinu sitagliptin zvyšuje uvolňování inzulínu a snižuje hladiny glukagonu v oběhu glukózově závislým způsobem. Sitagliptin vykazuje selektivitu pro DPP-4 a neinhibuje aktivitu DPP-8 nebo DPP-9 in vitro v koncentracích přibližných koncentracím z terapeutických dávek.
Metformin hydrochlorid
Metformin je antihyperglykemické činidlo, které zlepšuje glukózovou toleranci u pacientů s diabetem typu 2 a snižuje jak bazální, tak postprandiální plazmatickou glukózu. Jeho farmakologické mechanismy účinku se liší od jiných tříd orálních antihyperglykemických látek. Metformin snižuje produkci glukózy v játrech, snižuje absorpci glukózy ve střevě a zlepšuje citlivost na inzulín zvýšením absorpce a využití periferní glukózy. Na rozdíl od sulfonylmočovin metformin nevyvolává hypoglykémii ani u pacientů s diabetem typu 2 ani u normálních osob (s výjimkou zvláštních okolností [viz Varování a bezpečnostní opatření]) a nezpůsobuje hyperinzulinémii. Při léčbě metforminem zůstává sekrece inzulínu nezměněna, zatímco hladiny inzulínu nalačno nalačno a celodenní plazmatická odpověď na inzulín se mohou ve skutečnosti snížit.
12.2 Farmakodynamika
Sitagliptin
Všeobecné
U pacientů s diabetem 2. typu vedlo podávání sitagliptinu k inhibici enzymatické aktivity DPP-4 po dobu 24 hodin. Po perorálním podání glukózy nebo jídle vedla tato inhibice DPP-4 k 2- až 3násobnému zvýšení hladin cirkulujícího aktivního GLP-1 a GIP, snížené koncentrace glukagonu a zvýšená citlivost uvolňování inzulínu na glukózu, což má za následek vyšší C-peptid a inzulín koncentrace. Vzestup inzulinu se snížením glukagonu byl spojen s nižšími koncentracemi glukózy na lačno a sníženým výkyvem glukózy po perorálním podání glukózy nebo jídlem.
Souběžné podávání sitagliptinu a metformin hydrochloridu
Ve dvoudenní studii u zdravých jedinců zvyšoval samotný sitagliptin koncentrace aktivního GLP-1, zatímco metformin sám zvyšoval aktivní a celkovou koncentraci GLP-1 v podobném rozsahu. Současné podávání sitagliptinu a metforminu mělo aditivní účinek na aktivní koncentrace GLP-1. Sitagliptin, ale nikoli metformin, zvyšoval aktivní GIP koncentrace. Není jasné, co tyto nálezy znamenají pro změny v glykemické kontrole u pacientů s diabetem 2. typu.
Ve studiích se zdravými jedinci sitagliptin nesnížil hladinu glukózy v krvi ani nezpůsobil hypoglykémii.
Srdeční elektrofyziologie
V randomizované, placebem kontrolované zkřížené studii bylo 79 zdravým jedincům podáno jednorázové perorální dávka 100 mg sitagliptinu, 800 mg sitagliptinu (8násobek doporučené dávky) a placebo. Při doporučené dávce 100 mg nebyl žádný vliv na QTc interval dosažený při maximální plazmatické koncentraci ani v žádném jiném čase během studie. Po dávce 800 mg bylo maximální zvýšení průměrné změny QTc korigované na placebo od základní hodnoty 3 hodiny po podání dávky 8,0 ms. Toto zvýšení se nepovažuje za klinicky významné. Při dávce 800 mg byly maximální plazmatické koncentrace sitagliptinu přibližně 11krát vyšší než maximální koncentrace po 100 mg dávce.
U pacientů s diabetes mellitus 2. typu se podává sitagliptin 100 mg (N = 81) nebo sitagliptin 200 mg (N = 63) denně nebyly žádné významné změny v intervalu QTc na základě dat EKG získaných v době očekávané maximální plazmy koncentrace.
Farmakokinetika
Janumet
Výsledky studie bioekvivalence u zdravých jedinců prokázaly, že přípravek Janumet (sitagliptin / metformin HCl) 50 mg / 500 kombinované tablety mg a 50 mg / 1000 mg jsou bioekvivalentní současnému podávání odpovídajících dávek sitagliptinu (JANUVIA™2) a hydrochlorid metforminu jako jednotlivé tablety.
Vstřebávání
Sitagliptin
Absolutní biologická dostupnost sitagliptinu je přibližně 87%. Souběžné podávání vysokotučného jídla se sitagliptinem nemělo žádný vliv na farmakokinetiku sitagliptinu.
Metformin hydrochlorid
Absolutní biologická dostupnost 500 mg tablety metformin-hydrochloridu podávané nalačno je přibližně 50-60%. Studie používající jednotlivé perorální dávky tablet metformin hydrochloridu 500 mg až 1500 mg a 850 mg až 2550 mg naznačují, že existuje nedostatek proporcionality dávky se zvyšujícími se dávkami, který je způsoben spíše sníženou absorpcí než změnou eliminace. Jídlo snižuje rozsah a mírně zpomaluje absorpci metforminu, jak ukazuje přibližně o 40% nižší průměrná maximální koncentrace v plazmě (Cmax), o 25% nižší plocha pod křivkou koncentrace v plazmě v závislosti na čase (AUC) a 35minutové prodloužení času do dosažení maximální koncentrace v plazmě (T)max) po podání jedné 850mg tablety metforminu s jídlem, ve srovnání se stejnou silou tablety nalačno. Klinický význam těchto poklesů není znám.
Rozdělení
Sitagliptin
Průměrný distribuční objem v ustáleném stavu po jedné 100mg intravenózní dávce sitagliptinu zdravým osobám je přibližně 198 litrů. Frakce sitagliptinu reverzibilně vázaného na plazmatické proteiny je nízká (38%).
Metformin hydrochlorid
Zdánlivý distribuční objem (V / F) metforminu po jedné orální dávce tablet metformin hydrochloridu 850 mg byl průměrně 654 ± 358 L. Metformin se zanedbatelně váže na plazmatické proteiny, na rozdíl od sulfonylmočovin, na které se váže více než 90% proteinů. Metforminové dělení na erytrocyty, s největší pravděpodobností jako funkce času. Při obvyklých klinických dávkách a dávkovacích schématech tablet metformin-hydrochloridu je plazmatických koncentrací metforminu v rovnovážném stavu dosaženo během 24–48 hodin a obvykle
Metabolismus
Sitagliptin
Přibližně 79% sitagliptinu se vylučuje nezměněné močí, metabolismus je vedlejší cestou vylučování.
Po [14C] perorální dávka sitagliptinu, přibližně 16% radioaktivity bylo vyloučeno jako metabolity sitagliptinu. Bylo zjištěno šest metabolitů ve stopových hladinách a neočekává se, že bude přispívat k inhibiční aktivitě sitagliptinu v plazmě DPP-4. Studie in vitro ukázaly, že primárním enzymem odpovědným za omezený metabolismus sitagliptinu byl CYP3A4 s příspěvkem z CYP2C8.
Metformin hydrochlorid
Intravenózní studie s jednou dávkou u normálních jedinců ukazují, že metformin je vylučován v nezměněné podobě moč a nepodléhá jaternímu metabolismu (u lidí nebyly identifikovány žádné metabolity) ani biliární vylučování.
Vylučování
Sitagliptin
Po podání ústní [14C] dávka sitagliptinu zdravým osobám, přibližně 100% podané radioaktivity bylo vyloučeno stolicí (13%) nebo močí (87%) během jednoho týdne po podání. Zdánlivý terminál t1/2 po perorální dávce 100 mg sitagliptinu bylo přibližně 12,4 hodin a renální clearance byla přibližně 350 ml / min.
K vylučování sitagliptinu dochází primárně vylučováním ledvinami a zahrnuje aktivní tubulární sekreci. Sitagliptin je substrátem pro lidský organický anionový transportér-3 (hOAT-3), který se může podílet na renální eliminaci sitagliptinu. Klinický význam hOAT-3 v transportu sitagliptinu nebyl stanoven. Sitagliptin je také substrátem p-glykoproteinu, který může být také zapojen do zprostředkování renální eliminace sitagliptinu. Cyklosporin, inhibitor p-glykoproteinu, však nesnížil renální clearance sitagliptinu.
Metformin hydrochlorid
Renální clearance je přibližně 3,5krát větší než clearance kreatininu, což naznačuje, že tubulární sekrece je hlavní cestou eliminace metforminu. Po perorálním podání je přibližně 90% absorbovaného léčiva eliminováno renální cestou během prvních 24 hodin, s plazmatickým eliminačním poločasem přibližně 6,2 hodin. V krvi je eliminační poločas přibližně 17,6 hodin, což naznačuje, že masa erytrocytů může být distribučním oddílem.
Zvláštní populace
Renální nedostatečnost
Janumet
Přípravek Janumet by neměly užívat pacienti s renální nedostatečností [viz Kontraindikace; Varování a bezpečnostní opatření].
Sitagliptin
U pacientů se středně těžkou renální nedostatečností bylo pozorováno přibližně dvojnásobné zvýšení plazmatické AUC sitagliptinu a přibližně čtyřikrát u pacientů se závažnou renální nedostatečností včetně pacientů s ESRD na hemodialýze bylo pozorováno zvýšení ve srovnání s normální zdravou kontrolou předmětů.
Metformin hydrochlorid
U pacientů se sníženou funkcí ledvin (na základě změřené clearance kreatininu) plazmatický poločas a krevní poločas Metformin je prodloužen a renální clearance je snížena úměrně ke snížení kreatininu odbavení.
Jaterní nedostatečnost
Sitagliptin
U pacientů se středně těžkou jaterní nedostatečností (Child-Pugh skóre 7 až 9) je průměrná AUC a Cmax sitagliptinu vzrostl přibližně o 21%, respektive 13%, ve srovnání se zdravými kontrolními kontrolami po podání jediné dávky 100 mg sitagliptinu. Tyto rozdíly nejsou považovány za klinicky významné.
U pacientů s těžkou jaterní nedostatečností (skóre Child-Pugh> 9) neexistují žádné klinické zkušenosti.
Metformin hydrochlorid
U pacientů s jaterní nedostatečností nebyly provedeny žádné farmakokinetické studie metforminu.
Rod
Sitagliptin
Pohlaví nemělo klinicky významný účinek na farmakokinetiku sitagliptinu založeného na kompozitu analýza farmakokinetických údajů fáze I a populační farmakokinetické analýzy fáze I a fáze II data.
Metformin hydrochlorid
Farmakokinetické parametry metforminu se při analýze podle pohlaví významně nelišily mezi normálními jedinci a pacienty s diabetem 2. typu. Podobně v kontrolovaných klinických studiích u pacientů s diabetem 2. typu byl antihyperglykemický účinek metforminu u mužů a žen srovnatelný.
Geriatrické
Sitagliptin
Když se vezme v úvahu účinek věku na funkci ledvin, věk sám neměl klinicky významný dopad na farmakokinetiku sitagliptinu na základě populační farmakokinetiky analýza. Starší jedinci (65 až 80 let) měli přibližně o 19% vyšší plazmatické koncentrace sitagliptinu ve srovnání s mladšími subjekty.
Metformin hydrochlorid
Omezené údaje z kontrolovaných farmakokinetických studií metforminu u zdravých starších jedinců naznačují, že celková plazmatická clearance metforminu je snížena, poločas je prodloužen a Cmax je ve srovnání se zdravými mladými subjekty vyšší. Z těchto údajů se zdá, že změna farmakokinetiky metforminu se stárnutím je primárně způsobena změnou renálních funkcí (viz GLUCOPHAGE).3 předepisující informace: KLINICKÁ FARMAKOLOGIE, Speciální populace, geriatrie).
Léčba přípravkem Janumet by neměla být zahájena u pacientů ve věku 80 let, pokud měření clearance kreatininu neprokáže, že funkce ledvin není snížena [viz Varování a bezpečnostní opatření].
Pediatric
U pediatrických pacientů nebyly provedeny žádné studie s přípravkem Janumet.
Závod
Sitagliptin
Rasa neměla klinicky významný účinek na farmakokinetiku sitagliptinu na základě kompozitní analýzy dostupných farmakokinetických údajů, včetně subjektů bílé, hispánské, černé, asijské a dalších rasových skupiny.
Metformin hydrochlorid
Nebyly provedeny žádné studie farmakokinetických parametrů metforminu podle rasy. V kontrolovaných klinických studiích s metforminem u pacientů s diabetem 2. typu byl antihyperglykemický účinek srovnatelný u bílých (n = 249), černých (n = 51) a hispánských (n = 24).
Index tělesné hmotnosti (BMI)
Sitagliptin
Index tělesné hmotnosti neměl klinicky významný účinek na farmakokinetiku sitagliptinu založeného na kompozitu analýza farmakokinetických údajů fáze I a populační farmakokinetické analýzy fáze I a fáze II data.
Lékové interakce
Sitagliptin a hydrochlorid metforminu
Bylo provedeno společné podávání více dávek sitagliptinu (50 mg) a metforminu (1000 mg) podávaných dvakrát denně nemění významně farmakokinetiku sitagliptinu ani metforminu u pacientů s typem 2 cukrovka.
Farmakokinetické studie lékových interakcí s přípravkem Janumet nebyly provedeny; tyto studie však byly provedeny s jednotlivými složkami přípravku Janumet (sitagliptin a hydrochlorid metforminu).
Sitagliptin
Hodnocení drogových interakcí in vitro
Sitagliptin není inhibitorem CYP isozymů CYP3A4, 2C8, 2C9, 2D6, 1A2, 2C19 nebo 2B6 a není induktorem CYP3A4. Sitagliptin je substrátem p-glykoproteinu, ale neinhibuje transport digoxinu zprostředkovaný p-glykoproteinem. Na základě těchto výsledků není pravděpodobné, že by sitagliptin způsoboval interakce s jinými léky, které tyto cesty využívají.
Sitagliptin se ve velké míře neváže na plazmatické proteiny. Proto je sklon sitagliptinu k účasti na klinicky významných lékových interakcích zprostředkovaných vytěsněním vazby na plazmatické proteiny velmi nízký.
In vivo hodnocení lékových interakcí
Vliv sitagliptinu na jiné léky
V klinických studiích, jak je popsáno níže, sitagliptin významně nezměnil farmakokinetiku metforminu, glyburidu, simvastatinu, rosiglitazonu, warfarinu nebo orální antikoncepční prostředky, poskytující in vivo důkaz nízké náchylnosti k vyvolávání lékových interakcí se substráty CYP3A4, CYP2C8, CYP2C9 a organickým kationtovým transportérem (OCT).
Digoxin: Sitagliptin měl minimální účinek na farmakokinetiku digoxinu. Po současném podávání 0,25 mg digoxinu se 100 mg sitagliptinu denně po dobu 10 dnů byla AUC digoxinu v plazmě zvýšena o 11% a plazmatická Cmax o 18%.
Sulfonylmočoviny: Farmakokinetika jedné dávky glyburidu, substrátu CYP2C9, nebyla významně změněna u subjektů, které dostávaly více dávek sitagliptinu. Klinicky významné interakce by se neočekávaly s jinými sulfonylmočovinami (např. Glipizidem, tolbutamidem a glimepiridem), které jsou podobně jako glyburid primárně eliminovány CYP2C9 [viz Varování a bezpečnostní opatření].
Simvastatin: Farmakokinetika jednorázové dávky simvastatinu, substrátu CYP3A4, nebyla významně změněna u subjektů, které dostávaly více denních dávek sitagliptinu. Sitagliptin proto není inhibitorem metabolismu zprostředkovaného CYP3A4.
Thiazolidindiony: Farmakokinetika jednorázové dávky rosiglitazonu nebyla u jedinců významně změněna dostávající vícečetné denní dávky sitagliptinu, což naznačuje, že sitagliptin není inhibitorem zprostředkovaného CYP2C8 metabolismus.
Warfarin: Opakované denní dávky sitagliptinu nezměnily významně farmakokinetiku, jak bylo stanoveno měřením S (-) nebo R (+) warfarinové enantiomery nebo farmakodynamika (podle hodnocení protrombinového INR) jedné dávky warfarin. Protože S (-) warfarin je primárně metabolizován CYP2C9, tyto údaje rovněž podporují závěr, že sitagliptin není inhibitorem CYP2C9.
Perorální antikoncepce: Současné podávání se sitagliptinem významně nezměnilo farmakokinetiku v rovnovážném stavu norethindronu nebo ethinylestradiolu.
Účinek jiných léků na sitagliptin
Klinické údaje popsané níže naznačují, že sitagliptin není citlivý na klinicky významné interakce při současném podávání léků.
Cyklosporin: Byla provedena studie k posouzení účinku cyklosporinu, účinného inhibitoru p-glykoproteinu, na farmakokinetiku sitagliptinu. Společné podání jedné 100mg perorální dávky sitagliptinu a jedné 600mg perorální dávky cyklosporinu zvýšilo AUC a Cmax sitagliptinu přibližně o 29%, respektive 68%. Tyto skromné změny ve farmakokinetice sitagliptinu nebyly považovány za klinicky významné. Renální clearance sitagliptinu se také významně nezměnila. Smyslné interakce by se proto neočekávaly s jinými inhibitory p-glykoproteinu.
Metformin hydrochlorid
[Vidět Lékové interakce]
horní
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Janumet
S kombinovanými přípravky v přípravku Janumet nebyly provedeny žádné studie na zvířatech k vyhodnocení karcinogeneze, mutageneze nebo poškození plodnosti. Následující údaje vycházejí ze zjištění ve studiích se sitagliptinem a metforminem samostatně.
Sitagliptin
U samců a samic potkanů, kterým byla podávána perorální dávka sitagliptinu 50, 150 a 500 mg / kg / den, byla provedena dvouletá studie karcinogenity. U mužů a žen byl zvýšený výskyt kombinovaného jaterního adenomu / karcinomu a jaterního karcinomu u 500 mg / kg. Výsledkem této dávky je expozice přibližně 60krát vyšší než expozice člověka při maximální doporučené denní dávce pro dospělého člověka (MRHD) 100 mg / den na základě srovnání AUC. Nádory jater nebyly pozorovány při 150 mg / kg, což je přibližně 20násobek expozice člověka při MRHD. U samců a samic myší, kterým byla podávána perorální dávka sitagliptinu 50, 125, 250 a 500 mg / kg / den, byla provedena dvouletá studie karcinogenity. Výskyt nádorů v žádném orgánu nebyl zvýšen do 500 mg / kg, což je přibližně 70krát expozice člověka při MRHD. Sitagliptin nebyl mutagenní ani klastogenní s metabolickou aktivací nebo bez metabolické aktivace v testu bakteriální mutagenity Ames, vaječníku čínského křečka (CHO) chromozomální aberační test, in vitro cytogenetický test u CHO, in vitro test alkalické eluce krysí hepatocyty DNA a mikronukleus in vivo test.
Ve studiích fertility potkanů s perorálními dávkami žaludku 125, 250 a 1 000 mg / kg byli samci léčeni 4 týdny před pářením, během páření, až do plánovaného ukončení (celkem přibližně 8 týdnů), a samice byly léčeny 2 týdny před pářením prostřednictvím těhotenství den 7. Nebyl pozorován žádný nepříznivý účinek na plodnost při 125 mg / kg (přibližně 12krát expozice člověka při MRHD 100 mg / den na základě srovnání AUC). Při vyšších dávkách byly u žen pozorovány zvýšené resorpce u žen (přibližně 25 a 100krát expozice člověka při MRHD na základě srovnání AUC).
Metformin hydrochlorid
Byly provedeny dlouhodobé studie karcinogenity u potkanů (trvání dávky 104 týdnů) a myší (trvání dávky 91 týdnů) v dávkách až do 900 mg / kg / den včetně a 1500 mg / kg / den, resp. Tyto dávky jsou přibližně čtyřnásobkem maximální doporučené denní dávky pro člověka 2000 mg na základě srovnání povrchu těla. U samců nebo samic myší nebyly zjištěny žádné známky karcinogenity s metforminem. Podobně nebyl u samců potkanů pozorován žádný tumorigenní potenciál s metforminem. U samic potkanů léčených 900 mg / kg / den však došlo ke zvýšenému výskytu benigních stromálních děložních polypů.
V následujících testech in vitro nebyl prokázán mutagenní potenciál metforminu: Amesův test (S. S. typhimurium), test genové mutace (buňky myších lymfomů) nebo test chromozomálních aberací (lidské lymfocyty). Výsledky in vivo testu na mikronukleu myší byly také negativní. Plodnost samců nebo samic potkanů nebyla metforminem ovlivněna, pokud byly podávány v dávkách až 600 mg / kg / den, což je přibližně trojnásobek maximální doporučené denní dávky pro člověka na základě plochy povrchu těla srovnání.
horní
Klinické studie
Současné podávání sitagliptinu a metforminu bylo studováno u pacientů s diabetem 2. typu nedostatečně kontrolovaných dietou a cvičením a v kombinaci s glimepiridem.
S přípravkem Janumet nebyly provedeny žádné studie klinické účinnosti; byla však prokázána bioekvivalence přípravku Janumet se souběžně podávanými tabletami sitagliptinu a hydrochloridu metforminu.
Souběžné podávání sitagliptinu a metforminu u pacientů s diabetem typu 2 nedostatečně kontrolovaných dietou a cvičením
24 týdne se zúčastnilo celkem 1091 pacientů s diabetem 2. typu a nedostatečnou glykemickou kontrolou stravy a cvičení, randomizovaná, dvojitě zaslepená, placebem kontrolovaná faktoriální studie navržená k posouzení účinnosti sitagliptinu a metforminu společné podávání. Pacienti s antihyperglykemickým činidlem (N = 541) podstoupili dietu, cvičení a vymývání léčiva po dobu až 12 týdnů. Po vymývacím období byli pacienti s nedostatečnou glykemickou kontrolou (A1C 7,5% až 11%) randomizováni po dokončení dvoutýdenního jednorázově slepého placebového období. Pacienti bez antihyperglykemických látek při vstupu do studie (N = 550) s nedostatečnou kontrolou glykémie (A1C 7,5% až 11%) okamžitě vstoupilo do dvoutýdenního jednorázově slepého placebového období a poté bylo náhodně. Přibližně stejný počet pacientů byl randomizován k podávání placeba, 100 mg sitagliptinu jednou denně, 500 mg nebo 1 000 mg metforminu dvakrát denně nebo 50 mg sitagliptinu dvakrát denně v kombinaci s 500 mg nebo 1 000 mg metforminu dvakrát denně. Pacienti, kteří během studie nesplnili konkrétní glykemické cíle, byli léčeni záchranou glyburidem (glibenklamidem).
Společné podávání sitagliptinu a metforminu poskytlo významné zlepšení A1C, FPG a 2-hodinového PPG ve srovnání s placebem, samotným metforminem a samotným sitagliptinem (tabulka 3, obrázek 1). Průměrné snížení výchozí hodnoty u A1C bylo obecně větší u pacientů s vyššími výchozími hodnotami A1C. U pacientů, kteří v době vstupu do studie nebyli na antihyperglykemické látce, byla průměrná snížení výchozí hodnoty u A1C: sitagliptin 100 mg jednou denně, -1,1%; metformin 500 mg bid, -1,1%; metformin 1000 mg bid, -1,2%; sitagliptin 50 mg bid s metformin 500 mg bid, -1,6%; sitagliptin 50 mg dvakrát denně s metforminem 1000 mg dvakrát denně, -1,9%; a u pacientů užívajících placebo -0,2%. Lipidové účinky byly obecně neutrální. Snížení tělesné hmotnosti ve skupinách, kterým byl podáván sitagliptin v kombinaci s metforminem, bylo podobné jako ve skupinách, kterým byl podáván samotný metformin nebo placebo.
Tabulka 3: Glykemické parametry při závěrečné návštěvě (24týdenní studie) pro sitagliptin a metformin, samotné a v kombinaci u pacientů s diabetem typu 2 nedostatečně kontrolovaných dietou a cvičením *
Placebo |
Sitagliptin 100 mg QD |
Metformin 500 mg nabídky |
Metformin 1000 mg nabídky |
Sitagliptin 50 mg bid + Metformin 500 mg nabídky |
Sitagliptin 50 mg bid + Metformin 1000 mg nabídky |
|
| ||||||
| A1C (%) | N = 165 | N = 175 | N = 178 | N = 177 | N = 183 | N = 178 |
| Základní hodnota (průměr) | 8.7 | 8.9 | 8.9 | 8.7 | 8.8 | 8.8 |
| Změna ze základní hodnoty (upravený průměr†) | 0.2 | -0.7 | -0.8 | -1.1 | -1.4 | -1.9 |
| Rozdíl oproti placebu (upravený průměr†) (95% CI) |
-0.8C (-1.1, -0.6) |
-1.0C (-1.2, -0.8) |
-1.3C (-1.5, -1.1) |
-1.6C (-1.8, -1.3) |
-2.1C (-2.3, -1.8) |
|
| Pacienti (%) dosahující A1C <7% | 15 (9%) | 35 (20%) | 41 (23%) | 68 (38%) | 79 (43%) | 118 (66%) |
| % Pacientů, kteří dostávají záchranný lék | 32 | 21 | 17 | 12 | 8 | 2 |
| FPG (mg / dl) | N = 169 | N = 178 | N = 179 | N = 179 | N = 183 | N = 180 |
| Základní hodnota (průměr) | 196 | 201 | 205 | 197 | 204 | 197 |
| Změna ze základní hodnoty (upravený průměr†) | 6 | -17 | -27 | -29 | -47 | -64 |
| Rozdíl oproti placebu (upravený průměr†) (95% CI) |
-23C (-33, -14) |
-33C (-43, -24) |
-35C (-45, -26) |
-53C (-62, -43) |
-70C (-79, -60) |
|
| 2-hodinový PPG (mg / dl) | N = 129 | N = 136 | N = 141 | N = 138 | N = 147 | N = 152 |
| Základní hodnota (průměr) | 277 | 285 | 293 | 283 | 292 | 287 |
| Změna ze základní hodnoty (upravený průměr†) | 0 | -52 | -53 | -78 | -93 | -117 |
| Rozdíl oproti placebu (upravený průměr†) (95% CI) |
-52C (-67, -37) |
-54C (-69, -39) |
-78C (-93, -63) |
-93C (-107, -78) |
-117C (-131, -102) |
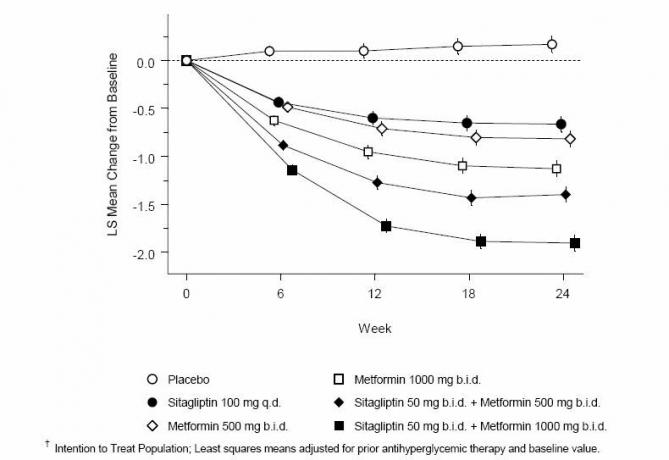
Obrázek 1: Průměrná změna oproti základní linii pro A1C (%) během 24 týdnů u sitagliptinu a metforminu, samotný a v kombinaci s pacienty s diabetem 2. typu nedostatečně kontrolovanými dietou a cvičením
Kromě toho tato studie zahrnovala pacienty (N = 117) s těžší hyperglykémií (A1C> 11% nebo krev) glukóza> 280 mg / dl), kteří byli léčeni dvakrát denně otevřeným sitagliptinem 50 mg a metforminem 1000 mg. V této skupině pacientů byla průměrná základní hodnota A1C 11,2%, průměrná FPG byla 314 mg / dl a průměrná 2hodinová PPG byla 441 mg / dl. Po 24 týdnech bylo pozorováno průměrné snížení oproti výchozím hodnotám -2,9% pro A1C, -127 mg / dl pro FPG a -208 mg / dl pro 2-hodinové PPG.
Počáteční kombinovaná terapie nebo udržování kombinované terapie by mělo být individualizované a je ponecháno na uvážení poskytovatele zdravotní péče.
Doplňková léčba sitagliptinem u pacientů s diabetem typu 2 nedostatečně kontrolovaná na metforminu samotném
Celkem 701 pacientů s diabetem 2. typu se účastnilo 24-týdenní, randomizované, dvojitě zaslepené, placebem kontrolované studie určené k posouzení účinnosti sitagliptinu v kombinaci s metforminem. Pacienti, kteří již byli léčeni metforminem (N = 431) v dávce alespoň 1500 mg denně, byli randomizováni po dokončení 2-týdenního, slepého, placebového období. Pacienti s metforminem a jiným antihyperglykemickým činidlem (N = 229) a pacienti bez antihyperglykemických látek (mimo terapii po dobu nejméně 8 týdny, N = 41) byly randomizovány po době záběhu přibližně 10 týdnů na metforminu (v dávce nejméně 1500 mg denně) v monoterapie. Pacienti byli randomizováni k přidání buď 100 mg sitagliptinu nebo placeba, podávaných jednou denně. Pacienti, kteří během studií nesplnili specifické glykemické cíle, byli léčeni záchranou pioglitazonu.
V kombinaci s metforminem sitagliptin poskytoval významné zlepšení A1C, FPG a 2-hodinového PPG ve srovnání s placebem s metforminem (tabulka 4). Záchranná glykemická terapie byla použita u 5% pacientů léčených sitagliptinem 100 mg a 14% pacientů léčených placebem. Podobné snížení tělesné hmotnosti bylo pozorováno u obou léčených skupin.
Tabulka 4: Glykemické parametry při závěrečné návštěvě (24týdenní studie) sitagliptinu v kombinované terapii s metforminem *
| Sitagliptin 100 mg QD + Metformin |
Placebo + Metformin |
|
| ||
| A1C (%) | N = 453 | N = 224 |
| Základní hodnota (průměr) | 8.0 | 8.0 |
| Změna ze základní hodnoty (upravený průměr†) | -0.7 | -0.0 |
| Rozdíl od placeba + metforminu (upravený průměr†) (95% CI) |
-0.7C (-0.8, -0.5) |
|
| Pacienti (%) dosahující A1C <7% | 213 (47%) | 41 (18%) |
| FPG (mg / dl) | N = 454 | N = 226 |
| Základní hodnota (průměr) | 170 | 174 |
| Změna ze základní hodnoty (upravený průměr†) | -17 | 9 |
| Rozdíl od placeba + metforminu (upravený průměr†) (95% CI) |
-25C (-31, -20) |
|
| 2-hodinový PPG (mg / dl) | N = 387 | N = 182 |
| Základní hodnota (průměr) | 275 | 272 |
| Změna ze základní hodnoty (upravený průměr†) | -62 | -11 |
| Rozdíl od placeba + metforminu (upravený průměr†) (95% CI) |
-51C (-61, -41) |
Doplňková terapie sitagliptinem u pacientů s diabetem typu 2 nedostatečně kontrolovaná kombinací metforminu a glimepiridu
Celkem 241 randomizovaných, dvojitě zaslepených pacientů se zúčastnilo 441 pacientů s diabetem 2. typu, placebem kontrolovaná studie určená k posouzení účinnosti sitagliptinu v kombinaci s glimepiridem, s nebo bez metforminu. Pacienti vstoupili do léčebné periody na samotném glimepiridu (± 4 mg denně) nebo glimepiridu v kombinaci s metforminem (± 1500 mg na den). Po titraci dávky a době záběhu stabilní po dobu až 16 týdnů a 2-týdenní době záběhu placeba u pacientů s nedostatečným kontrola glykémie (A1C 7,5% až 10,5%) byla randomizována na přidání buď 100 mg sitagliptinu nebo placeba, podaných jednou denně. Pacienti, kteří během studií nesplnili specifické glykemické cíle, byli léčeni záchranou pioglitazonu.
U pacientů užívajících sitagliptin s metforminem a glimepiridem došlo k významnému zlepšení A1C a FPG ve srovnání s pacienty, kteří dostávali placebo s metforminem a glimepiridem (tabulka 5), se středním snížením oproti výchozímu stavu v porovnání s placebem u A1C -0,9% a FPG -21 mg / dl. Záchranná terapie byla použita u 8% pacientů léčených sitagliptinem 100 mg a 29% pacientů léčených přídavným placebem. U pacientů léčených přídavným sitagliptinem došlo k průměrnému zvýšení tělesné hmotnosti o 1,1 kg oproti přídavné placebo (+0,4 kg vs. -0,7 kg). Navíc přidaný sitagliptin vedl ke zvýšené míře hypoglykémie ve srovnání s přídavným placebem. [Vidět Varování a bezpečnostní opatření; Nežádoucí reakce.]
Tabulka 5: Glykemické parametry při závěrečné návštěvě (24týdenní studie) pro sitagliptin v kombinaci s metforminem a glimepiridem *
| Sitagliptin 100 mg + Metformin a Glimepiride |
Placebo + Metformin a Glimepiride |
|
| ||
| A1C (%) | N = 115 | N = 105 |
| Základní hodnota (průměr) | 8.3 | 8.3 |
| Změna ze základní hodnoty (upravený průměr†) | -0.6 | 0.3 |
| Rozdíl oproti placebu (upravený průměr†) (95% CI) | -0.9C (-1.1, -0.7) |
|
| Pacienti (%) dosahující A1C <7% | 26 (23%) | 1 (1%) |
| FPG (mg / dl) | N = 115 | N = 109 |
| Základní hodnota (průměr) | 179 | 179 |
| Změna ze základní hodnoty (upravený průměr†) | -8 | 13 |
| Rozdíl oproti placebu (upravený průměr†) (95% CI) | -21C (-32, -10) |
Terapie přídavkem sitagliptinu vs. Doplňková terapie glipizidem u pacientů s diabetem typu 2 nedostatečně kontrolovaná na metforminu
Účinnost sitagliptinu byla hodnocena v 52týdenní, dvojitě zaslepené, glipizidem kontrolované neinferioritě u pacientů s diabetem 2. typu. Pacienti, kteří nebyli léčeni nebo jinými antihyperglykemiky, vstoupili do léčebné periody v trvání až 12 týdnů s monoterapií metforminem (dávka - 1500 mg denně), která zahrnovala vymýcení jiných léčiv než metforminu, pokud použitelný. Po období záběhu byli randomizováni jedinci s nedostatečnou glykemickou kontrolou (A1C 6,5% až 10%) 1: 1 po přidání 100 mg sitagliptinu jednou denně nebo glipizidu po dobu 52 týdnů. Pacientům, kterým byl podáván glipizid, byla podána úvodní dávka 5 mg / den a poté byla elektricky titrována v průběhu následujících 18 týdnů na maximální dávku 20 mg / den podle potřeby pro optimalizaci glykemické kontroly. Poté měla být dávka glipizidu udržována konstantní, s výjimkou titrace dolů, aby se zabránilo hypoglykémii. Průměrná dávka glipizidu po titrační době byla 10 mg.
Po 52 týdnech mělo sitagliptin a glipizid podobné průměrné snížení oproti výchozím hodnotám u A1C v analýze s úmyslem léčit (tabulka 6). Tyto výsledky byly konzistentní s analýzou podle protokolu (obrázek 2). Závěr ve prospěch non-inferiority sitagliptinu vůči glipizidu může být omezen na pacienty s výchozím stavem A1C srovnatelné s těmi zahrnutými ve studii (více než 70% pacientů mělo výchozí hodnotu A1C <8% a více než 90% mělo A1C <9%).
Tabulka 6: Glykemické parametry ve 52týdenní studii srovnávající sitagliptin s glipizidem jako doplňkovou terapii u pacientů nedostatečně kontrolovaných metforminem (populace, která má být léčena) *
| Sitagliptin 100 mg + Metformin |
Glipizide + Metformin |
|
| ||
| A1C (%) | N = 576 | N = 559 |
| Základní hodnota (průměr) | 7.7 | 7.6 |
| Změna ze základní hodnoty (upravený průměr†) | -0.5 | -0.6 |
| FPG (mg / dl) | N = 583 | N = 568 |
| Základní hodnota (průměr) | 166 | 164 |
| Změna ze základní hodnoty (upravený průměr†) | -8 | -8 |
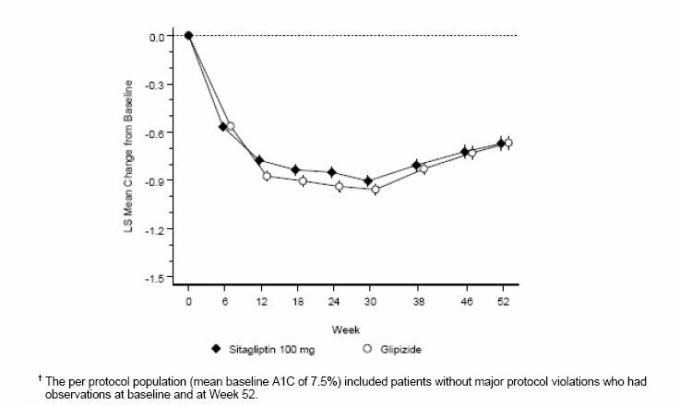
Obrázek 2: Střední změna oproti výchozím hodnotám pro A1C (%) během 52 týdnů ve studii srovnávající sitagliptin s Glipizid jako doplňková terapie u pacientů nedostatečně kontrolovaných na metformin (populace podle protokolu) â€
Výskyt hypoglykémie ve skupině sitagliptinů (4,9%) byl významně (p <0,001) nižší než ve skupině glipizidů (32,0%). U pacientů léčených sitagliptinem došlo k významnému průměrnému snížení tělesné hmotnosti oproti výchozímu stavu ve srovnání s významným přírůstkem tělesné hmotnosti u pacientů, kterým byl podáván glipizid (-1,5 kg vs. +1,1 kg).
horní
Jak dodáván
Č. 6747 - Tablety Janumet, 50 mg / 500 mg, jsou světle růžové, potahované tablety ve tvaru tobolky s vyraženým „575“ na jedné straně. Dodávají se takto:
NDC 0006-0575-61 lahve s jednotkou použití po 60
NDC 0006-0575-62 lahve s jednotkou použití o objemu 180
NDC 0006-0575-52 blistrové balení po 50 jednotkách
NDC 0006-0575-82 objemové láhve o objemu 1000.
Č. 6749 - Tablety Janumet, 50 mg / 1000 mg, jsou červené, potahované tablety ve tvaru tobolky s vyraženým „577“ na jedné straně. Dodávají se takto:
NDC 0006-0577-61 lahve s jednotkou použití po 60
NDC 0006-0577-62 lahve na jedno použití o objemu 180
NDC 0006-0577-52 blistrové balení po 50 jednotkových dávkách
NDC 0006-0577-82 objemové láhve o objemu 1000.
Uchovávejte při 20-25 ° C (68-77 ° F), exkurze jsou povoleny při 15-30 ° C (59-86 ° F).
horní
Informace pro pacienty
Instrukce
Pacienti by měli být informováni o možných rizicích a přínosech přípravku Janumet ao alternativních způsobech léčby. Měli by být také informováni o důležitosti dodržování dietních pokynů, pravidelné fyzické aktivity, pravidelné krve monitorování glukózy a testování A1C, rozpoznávání a řízení hypoglykémie a hyperglykémie a hodnocení diabetu komplikace. Během období stresu, jako je horečka, trauma, infekce nebo chirurgický zákrok, se mohou požadavky na léky změnit a pacienti by měli být poučeni, aby okamžitě vyhledali lékařskou pomoc.
Rizika laktátové acidózy v důsledku složky metforminu, jejích příznaků a stavů, které předurčují její vývoj, jak je uvedeno v Varování a bezpečnostní opatření, by mělo být vysvětleno pacientům. Pacientům by mělo být doporučeno, aby okamžitě přerušili léčbu přípravkem Janumet a aby neprodleně informovali svého lékaře o nevysvětlitelné hyperventilaci, myalgii, malátnost, neobvyklá ospalost, závratě, pomalý nebo nepravidelný srdeční rytmus, pocit nachlazení (zejména na končetinách) nebo jiné nespecifické příznaky nastat. Gastrointestinální příznaky jsou běžné při zahájení léčby metforminem a mohou se objevit během zahájení léčby přípravkem Janumet; pacienti by se však měli poradit s lékařem, pokud se u nich objeví nevysvětlitelné příznaky. Přestože gastrointestinální příznaky, které se objevují po stabilizaci, pravděpodobně nebudou souviset s léčivem, takový výskyt příznaků by měl být vyhodnocen, aby se zjistilo, zda může být způsoben laktátovou acidózou nebo jiným závažným choroba.
Během léčby přípravkem Janumet by pacienti měli být informováni o nadměrném příjmu alkoholu, ať už akutním nebo chronickém.
Při léčbě přípravkem Janumet by pacienti měli být informováni o důležitosti pravidelného testování renálních funkcí a hematologických parametrů.
Pacienti by měli být informováni, že během postmarketingového užívání sitagliptinu, jedné ze složek přípravku Janumet, byly hlášeny alergické reakce. Pokud se projeví alergické reakce (včetně vyrážky, kopřivky a otoku obličeje, rtů, jazyka a hrdla), způsobit potíže s dýcháním nebo polykáním), pacienti musí přestat užívat přípravek Janumet a vyhledat lékařskou pomoc okamžitě.
Lékaři by měli poučit své pacienty, aby si před zahájením léčby přípravkem Janumet přečetli příbalovou informaci pro pacienty a aby si ji znovu při každém obnovení předpisu přečetli. Pacienti by měli být poučeni, aby informovali svého lékaře nebo lékárníka, pokud se u nich vyskytnou neobvyklé příznaky, nebo pokud jakýkoli známý příznak přetrvává nebo se zhoršuje.
Laboratorní testy
Reakce na všechny diabetické terapie by měla být sledována periodickým měřením hladiny glukózy v krvi a hladin A1C s cílem snížit tyto hladiny směrem k normálnímu rozmezí. A1C je zvláště užitečný pro vyhodnocení dlouhodobé kontroly glykémie.
Počáteční a periodické monitorování hematologických parametrů (např. Hemoglobinu / hematokritu a červené krve) indexy buněk) a funkce ledvin (sérový kreatinin) by měly být prováděny alespoň jednou ročně. Přestože megaloblastická anémie byla při léčbě metforminem zřídkakdy pozorována, je-li to podezření, je třeba vyloučit nedostatek vitaminu B12.
Distribuovány:
MERCK & CO., INC., Whitehouse Station, NJ 08889, USA
9794108
US patent č.: 6 699 871
1 Registrovaná ochranná známka společnosti MERCK & CO., Inc., Whitehouse Station, New Jersey 08889 USA
2Trademark společnosti MERCK & CO., Inc., Whitehouse Station, New Jersey 08889 USA
3GLUCOPHAGE® je registrovaná ochranná známka společnosti Merck Sante S.A.S, spolupracovníka společnosti Merck KGaA v německém Darmstadtu.
Licencováno pro společnost Bristol-Myers Squibb.
COPYRIGHT © 2007, 2008 MERCK & CO., Inc.
Všechna práva vyhrazena
Označování pacientů schválené FDA
Informace o pacientech
Janumet® (JAN-you-met)
(sitagliptin / metformin HCl)
Tablety
Přečtěte si informace o pacientovi, které se dodávají s přípravkem Janumet1, dříve, než jej začnete užívat a pokaždé, když dostanete doplnění. Mohou existovat nové informace. Tato příbalová informace nenahrazuje rozhovor s lékařem o vašem zdravotním stavu nebo léčbě.
Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku Janumet?
Metformin hydrochlorid, jedna ze složek přípravku Janumet, může způsobit vzácný, ale závažný nežádoucí účinek nazývaný laktátová acidóza (nahromadění kyseliny mléčné v krvi), který může způsobit smrt. Laktátová acidóza je lékařská pohotovost a musí být léčena v nemocnici.
Přestaňte užívat přípravek Janumet a okamžitě kontaktujte svého lékaře, pokud se u vás vyskytne kterýkoli z následujících příznaků laktátové acidózy:
- Cítíte se velmi slabí a unavení.
- Máte neobvyklou (ne normální) bolest svalů.
- Máte potíže s dýcháním.
- Máte nevysvětlitelné žaludeční nebo střevní problémy s nevolností a zvracením nebo průjmem.
- Cítíte se zima, zejména v pažích a nohou.
- Cítíte se závratě nebo bezhlavě.
- Máte pomalý nebo nepravidelný srdeční rytmus.
Máte vyšší šanci na získání laktátové acidózy, pokud:
- mít problémy s ledvinami.
- mají problémy s játry.
- máte kongestivní srdeční selhání, které vyžaduje léčbu léky.
- pít hodně alkoholu (velmi často nebo krátkodobě pijící).
- dehydratovat (ztratit velké množství tělních tekutin). To se může stát, pokud jste nemocní horečkou, zvracením nebo průjmem. Dehydratace může také nastat, když se hodně potíte činností nebo cvičením a nepijete dostatek tekutin.
- mít určité rentgenové testy s injekčními barvivy nebo kontrastními látkami.
- mít operaci.
- máte srdeční infarkt, těžkou infekci nebo mrtvici.
- jsou ve věku 80 let nebo starší a nebyly testovány funkce ledvin.
Co je Janumet?
Tablety Janumet obsahují dva léky na předpis, sitagliptin (JANUVIA ™ 2) a metformin. Přípravek Janumet lze použít spolu se stravou a cvičením ke snížení hladiny cukru v krvi u dospělých pacientů s diabetem 2. typu. Váš lékař určí, zda je přípravek Janumet pro vás vhodný, a určí nejlepší způsob, jak začít a pokračovat v léčbě diabetu.
Janumet:
- pomáhá zlepšit hladinu inzulínu po jídle.
- pomáhá tělu lépe reagovat na inzulín, který vytváří přirozeně.
- snižuje množství cukru vyrobeného v těle.
- je nepravděpodobné, že způsobí nízkou hladinu cukru v krvi (hypoglykémie), pokud je užívána k léčbě vysoké hladiny cukru v krvi.
Přípravek Janumet nebyl studován u dětí mladších 18 let.
Přípravek Janumet nebyl zkoumán s inzulínem, o léku, o kterém je známo, že způsobuje nízkou hladinu cukru v krvi.
Kdo by neměl Janumet užívat?
Neužívejte přípravek Janumet, pokud:
- mají diabetes 1. typu.
- mají určité problémy s ledvinami.
- - máte stavy nazývané metabolická acidóza nebo diabetická ketoacidóza (zvýšené ketony v krvi nebo moči).
- měli alergickou reakci na Janumet nebo sitagliptin (JANUVIA), jednu ze složek přípravku Janumet.
- Pokud dostanou injekci barviva nebo kontrastních látek pro rentgenový zákrok, bude nutné Janumet na krátkou dobu zastavit. Poraďte se se svým lékařem o tom, kdy zastavit přípravek Janumet a kdy začít znovu. Viz „Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku Janumet?“
Co mám říct svému lékaři před a během léčby přípravkem Janumet?
Janumet nemusí být pro vás to pravé. Informujte svého lékaře o všech svých zdravotních stavech, včetně případů, kdy:
- mít problémy s ledvinami.
- mají problémy s játry.
- měli alergickou reakci na Janumet nebo sitagliptin (JANUVIA), jednu ze složek přípravku Janumet.
- máte srdeční problémy, včetně městnavého srdečního selhání.
- jsou starší než 80 let. Pacienti starší 80 let by neměli přípravek Janumet užívat, pokud není zkontrolována jejich funkce ledvin a je to normální.
- pít hodně alkoholu (po celou dobu nebo krátkodobé „flámování“ pití).
- jsou těhotná nebo plánují otěhotnět. Není známo, zda Janumet poškodí vaše nenarozené dítě. Pokud jste těhotná, poraďte se se svým lékařem o nejlepším způsobu kontroly hladiny cukru v krvi během těhotenství. Pokud používáte Janumet během těhotenství, poraďte se se svým lékařem, jak můžete být v registru Janumet. Bezplatné telefonní číslo pro rejstřík těhotenství je 1-800-986-8999.
- kojíte nebo plánujete kojit. Není známo, zda přípravek Janumet přechází do mateřského mléka. Promluvte si se svým lékařem o nejlepším způsobu, jak nakrmit své dítě, pokud užíváte přípravek Janumet.
Informujte svého lékaře o všech lécích, které užíváte, včetně léčivých přípravků na předpis a bez lékařského předpisu, vitamínů a bylinných doplňků. Janumet může ovlivnit, jak dobře fungují jiné léky, a některé léky mohou ovlivnit, jak dobře Janumet funguje.
Znáte léky, které užíváte. Uchovávejte si seznam svých léků a ukažte je svému lékaři a lékárníkovi, když dostanete nový lék. Před zahájením užívání jakéhokoli nového léku se poraďte se svým lékařem.
Jak mám vzít Janumet?
- Váš lékař vám řekne, kolik tablet Janumet máte užít a jak často je máte užívat. Užívejte přípravek Janumet přesně podle pokynů svého lékaře.
- Váš lékař bude možná muset zvýšit dávku, aby mohl kontrolovat hladinu cukru v krvi.
- Lékař vám může předepsat přípravek Janumet spolu se sulfonylmočovinou (další lék ke snížení hladiny cukru v krvi). Viz „Jaké jsou možné nežádoucí účinky přípravku Janumet?“ informace o zvýšeném riziku nízkého cukru v krvi.
- Užívejte Janumet s jídlem, abyste snížili šanci na žaludek.
- Pokračujte v užívání přípravku Janumet tak dlouho, jak vám řekne lékař.
- Pokud užijete příliš mnoho přípravku Janumet, okamžitě kontaktujte svého lékaře nebo toxikologické středisko.
- Pokud vynecháte dávku, užijte ji s jídlem, jakmile si vzpomenete. Pokud si nepamatujete, že je čas na další dávku, přeskočte vynechanou dávku a vraťte se do svého pravidelného režimu. Neužívejte dvě dávky přípravku Janumet současně.
- Možná budete muset přestat užívat Janumet na krátkou dobu. Pokyny získáte, pokud:
- jsou dehydratované (ztratily příliš mnoho tělesné tekutiny). Dehydratace může nastat, pokud jste nemocní při silném zvracení, průjmu nebo horečce, nebo pokud pijete mnohem méně tekutin, než je obvyklé.
- plánovat operaci.
- dostanou injekci barviva nebo kontrastního činidla pro rentgenovou proceduru.
Viz „Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku Janumet?“ a „Kdo by neměl Janumet vzít?“
- Pokud je vaše tělo vystaveno stresu, jako je horečka, trauma (například dopravní nehoda), infekce nebo chirurgický zákrok, může se změnit množství léku na diabetes, které potřebujete. Pokud se u Vás vyskytne některý z těchto stavů, sdělte to ihned svému lékaři a postupujte podle pokynů svého lékaře.
- Sledujte hladinu cukru v krvi podle pokynů lékaře.
- Během užívání přípravku Janumet dodržujte předepsanou dietu a cvičební program.
- Poraďte se se svým lékařem o tom, jak předcházet, rozpoznávat a řídit nízkou hladinu cukru v krvi (hypoglykémie), vysokou hladinu cukru v krvi (hyperglykémie) a komplikace diabetu.
- Váš lékař bude pravidelně sledovat vaše cukrovky, včetně hladin cukru v krvi a hemoglobinu A1C.
- Váš lékař provede krevní testy, aby zkontroloval funkci ledvin před a během léčby přípravkem Janumet.
Jaké jsou možné nežádoucí účinky přípravku Janumet?
Přípravek Janumet může způsobit vážné nežádoucí účinky. Viz „Jaké jsou nejdůležitější informace, které bych měl vědět o přípravku Janumet?“
Mezi běžné nežádoucí účinky při užívání přípravku Janumet patří:
- ucpaný nebo rýma a bolest v krku
- infekce horních cest dýchacích
- průjem
- nevolnost a zvracení
- plyn, žaludeční potíže, zažívací potíže
- slabost
- bolest hlavy
Užívání přípravku Janumet s jídlem může pomoci snížit běžné vedlejší účinky metforminu na žaludek, které se obvykle vyskytují na začátku léčby. Pokud máte neobvyklé nebo neočekávané potíže se žaludkem, promluvte si se svým lékařem. Problémy se žaludkem, které se objevují později během léčby, mohou být známkou něčeho vážnějšího.
Některé léky na cukrovku, jako jsou sulfonylmočoviny a meglitinidy, mohou způsobit nízkou hladinu cukru v krvi (hypoglykémie). Pokud se Janumet používá s těmito léky, můžete mít příliš nízkou hladinu cukru v krvi. Váš lékař může předepsat nižší dávky sulfonylmočoviny nebo meglitinidu. Informujte svého lékaře, pokud máte problémy s nízkou hladinou cukru v krvi.
Následující obecné nežádoucí účinky byly hlášeny obecně u přípravku Janumet nebo sitagliptinu:
- U přípravku Janumet nebo sitagliptinu, jednoho z léčivých přípravků v přípravku Janumet, se mohou objevit závažné alergické reakce. Příznaky závažné alergické reakce mohou zahrnovat vyrážku, kopřivku a otok obličeje, rtů, jazyka a krku, potíže s dýcháním nebo polykáním. Pokud máte alergickou reakci, přestaňte přípravek Janumet užívat a ihned zavolejte svého lékaře. Lékař vám může předepsat léky na léčbu alergické reakce a jiné léky na cukrovku.
- Zvýšené jaterní enzymy.
- Zánět slinivky břišní.
To nejsou všechny možné vedlejší účinky přípravku Janumet. Další informace získáte od svého lékaře.
Informujte svého lékaře, pokud máte jakýkoli nežádoucí účinek, který vám vadí, je neobvyklý nebo nezmizí.
Jak mám Janumet uchovávat?
Uchovávejte přípravek Janumet při pokojové teplotě, 20-25 ° C.
Uchovávejte přípravek Janumet a všechny léky mimo dosah dětí.
Obecné informace o používání přípravku Janumet
Léčivé přípravky jsou někdy předepisovány pro stavy, které nejsou uvedeny v příbalových informacích pro pacienty. Nepoužívejte přípravek Janumet pro stav, pro který není předepsán. Nedávejte Janumet jiným lidem, i když mají stejné příznaky, jaké máte. Může jim to ublížit.
Tento leták shrnuje nejdůležitější informace o přípravku Janumet. Pokud byste chtěli vědět více informací, promluvte si se svým lékařem. Můžete požádat svého lékaře nebo lékárníka o informace o přípravku Janumet, které jsou napsány pro zdravotnické pracovníky. Pro více informací volejte 1-800-622-4477.
Jaké jsou složky přípravku Janumet?
Účinné látky: sitagliptin a metformin hydrochlorid.
Neaktivní složky: mikrokrystalická celulóza, polyvinylpyrrolidon, laurylsulfát sodný a stearylfumarát sodný. Filmový potah tablety obsahuje následující neaktivní složky: polyvinylalkohol, polyethylenglykol, talek, oxid titaničitý, červený oxid železitý a černý oxid železitý.
Co je to diabetes 2. typu?
Diabetes 2. typu je stav, při kterém vaše tělo nevytváří dostatek inzulínu a inzulín, který vaše tělo produkuje, nefunguje tak, jak by měl. Vaše tělo může také vyrobit příliš mnoho cukru. Když k tomu dojde, hromadí se v krvi cukr (glukóza). To může vést k vážným zdravotním problémům.
Hlavním cílem léčby cukrovky je snížit hladinu cukru v krvi na normální úroveň. Snížení a kontrola hladiny cukru v krvi může pomoci zabránit nebo oddálit komplikace diabetu, jako jsou srdeční problémy, problémy s ledvinami, slepota a amputace.
Vysoká hladina cukru v krvi může být snížena dietou a cvičením av případě potřeby některými léky.
Vydáno v březnu 2009
Distribuovány:
MERCK & CO., INC., Whitehouse Station, NJ 08889, USA
Poslední aktualizace: 03/09
Janumet, sitagliptin a metformin hydrochlorid, informace o pacientech (v prosté angličtině)
Podrobné informace o příznacích, příznacích, příčinách, léčbě cukrovky
Účelem informací v této monografii není pokrýt všechna možná použití, pokyny, preventivní opatření, lékové interakce nebo nepříznivé účinky. Tyto informace jsou zobecněné a neslouží jako zvláštní lékařská pomoc. Máte-li dotazy týkající se léků, které užíváte, nebo byste chtěli získat více informací, obraťte se na svého lékaře, lékárníka nebo zdravotní sestru.
zpět k: Procházet všechny léky na cukrovku



