Glyset pro léčbu cukrovky
Název značky: Glyset
Obecný název: Miglitol
Obsah:
Popis
Klinická farmakologie
Klinické studie
Indikace a použití
Kontraindikace
Opatření
Nežádoucí reakce
Předávkování
Dávkování a správa
Jak se dodává
Glyset, miglitol, informace o pacientech (v prosté angličtině)
Popis
Přípravek GLYSET obsahuje miglitol, perorální inhibitor alfa-glukosidázy, který se používá při léčbě diabetes mellitus nezávislého na inzulínu (NIDDM). Miglitol je derivát desoxynojirimycinu a je chemicky známý jako 3,4,5-piperidintriol, 1- (2-hydroxyethyl) -2- (hydroxymethyl) -, [2R- (2Î ±, 3β, 4Î ±, 5β)] -. Je to bílý až světle žlutý prášek s molekulovou hmotností 207,2. Miglitol je rozpustný ve vodě a má pKa 5,9. Jeho empirický vzorec je C8H17NO5 a jeho chemická struktura je následující:
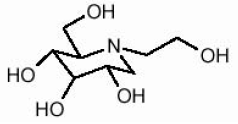
Přípravek GLYSET je k dispozici jako 25 mg, 50 mg a 100 mg tablety pro perorální podání. Neaktivní složky jsou škrob, mikrokrystalická celulóza, stearát hořečnatý, hypromelóza, polyethylenglykol, oxid titaničitý a polysorbát 80.
horní
Klinická farmakologie
Miglitol je derivát desoxynojirimycinu, který zpomaluje trávení požitých sacharidů, což má za následek menší zvýšení koncentrace glukózy v krvi po jídle. V důsledku snížení hladiny glukózy v plazmě GLYSET tablety snižují hladiny glykosylovaného hemoglobinu u pacientů s diabetes mellitus II. Typu (nezávislého na inzulínu). Systémová neenzymatická glykosylace bílkovin, jak se odráží v hladinách glykosylovaného hemoglobinu, je funkcí průměrné koncentrace glukózy v krvi v čase.
Mechanismus účinku
Na rozdíl od sulfonylmočovin GLYSET nezvyšuje sekreci inzulínu. Antihyperglykemický účinek miglitolu je výsledkem reverzibilní inhibice střevních enzymů Î ± -glukosid hydrolázy vázaných na membránu. Střevní est ± glukosidázy vázané na membránu hydrolyzují oligosacharidy a disacharidy na glukózu a jiné monosacharidy na okraji kartáče tenkého střeva. U diabetických pacientů má tato inhibice enzymu zpožděnou absorpci glukózy a snížení postprandiální hyperglykémie.
Protože je jeho mechanismus účinku odlišný, je účinek GLYSETu na zvýšení glykemické kontroly aditivní k účinku sulfonylmočoviny, pokud je použit v kombinaci. Kromě toho GLYSET snižuje inzulinotropní a zvyšující účinky sulfonylmočovin.
Miglitol má malou inhibiční aktivitu proti laktáze, a proto by se při doporučených dávkách neočekávalo, že by indukoval intoleranci laktózy.
Farmakokinetika
Vstřebávání
Absorpce miglitolu je saturovatelná při vysokých dávkách: dávka 25 mg je zcela absorbována, zatímco dávka 100 mg je absorbována pouze 50% - 70%. Pro všechny dávky je maximální koncentrace dosaženo za 2-3 hodiny. Neexistuje důkaz, že systémová absorpce miglitolu přispívá k jeho terapeutickému účinku.
Rozdělení
Vazba miglitolu na bílkoviny je zanedbatelná (<4,0%). Miglitol má distribuční objem 0,18 l / kg, což odpovídá distribuci primárně do extracelulární tekutiny.
Metabolismus
Miglitol není metabolizován u člověka ani u žádného ze sledovaných živočišných druhů. V plazmě, moči nebo ve stolici nebyly detekovány žádné metabolity, což svědčí o nedostatku systémového nebo předsystémového metabolismu.
Vylučování
Miglitol je vylučován ledvinami jako nezměněné léčivo. Po podání dávky 25 mg se tedy v moči získá více než 95% dávky do 24 hodin. Při vyšších dávkách je kumulativní zotavení léčiva z moči o něco nižší kvůli neúplné biologické dostupnosti. Eliminační poločas miglitolu z plazmy je přibližně 2 hodiny.
Zvláštní populace
Renální postižení
Protože miglitol je vylučován primárně ledvinami, u pacientů s poškozením ledvin se očekává akumulace miglitolu. Pacienti s clearance kreatininu 60 ml / min. Úprava dávky pro úpravu zvýšených plazmatických koncentrací není možná, protože miglitol působí lokálně. O bezpečnosti miglitolu u pacientů s clearance kreatininu <25 ml / min je k dispozici jen málo informací.
Poškození jater
Farmakokinetika Miglitolu se u cirhózních pacientů nezměnila ve srovnání se zdravými kontrolními subjekty. Protože miglitol není metabolizován, neočekává se žádný vliv jaterních funkcí na kinetiku miglitolu.
Rod
Při zohlednění tělesné hmotnosti nebyl mezi staršími muži a ženami pozorován žádný významný rozdíl ve farmakokinetice miglitolu.
Závod
U japonských dobrovolníků bylo provedeno několik farmakokinetických studií, jejichž výsledky byly podobné těm, které byly pozorovány u bělochů. Studie srovnávající farmakodynamickou odpověď na jednorázovou dávku 50 mg u zdravých dobrovolníků v Černé a Kavkazské republice ukázala podobné glukózové a inzulínové odpovědi v obou populacích.
horní
Klinické studie
Klinické zkušenosti u pacientů bez diabetes mellitus nezávislých na inzulínu (NIDDM) pouze při dietetické léčbě
Tablety GLYSET byly hodnoceny ve dvou studiích o monoterapii s pevnou dávkou v USA a ve třech studiích s kontrolovanou dávkou, které nebyly kontrolovány USA, ve kterých bylo 735 pacientů léčených přípravkem GLYSET hodnoceno na analýzu účinnosti (viz tabulka 1).
Ve studii 1, jednoleté studii, ve které byl GLYSET hodnocen jako monoterapie a také jako kombinovaná terapie, byla statisticky signifikantně menší zvýšení průměrného glykosylovaného hemoglobinu (HbA1c) v čase v rameni miglitolu 50 mg 3krát denně ve srovnání s monoterapií na placebo. U pacientů léčených GLYSETem bylo ve srovnání se skupinou s placebem pozorováno významné snížení průměrných hladin glukózy v plazmě a postprandiální plazmy a průměrných hladin postprandiálního inzulínu.
Ve studii 2, 14týdenní studii, došlo k signifikantnímu snížení HbA1c u pacientů, kteří dostávali GLYSET 50 mg 3x denně nebo 100 mg 3krát denně ve srovnání s placebem. Kromě toho došlo k významnému snížení hladiny postprandiální plazmatické glukózy a postprandiální hladiny sérového inzulínu ve srovnání s placebem.
Studie 3 byla šestiměsíční studie zaměřená na dávku, která hodnotila GLYSET v dávkách od 25 mg 3krát denně do 200 mg 3krát denně. GLYSET způsobil větší snížení HbA1c než placebo ve všech dávkách, ačkoli účinek byl statisticky významný pouze při dávkách 100 mg 3krát denně a 200 mg 3krát denně. Kromě toho všechny dávky přípravku GLYSET způsobily významné snížení hladin glukózy v plazmě a postprandiální hladiny inzulínu ve srovnání s placebem.
Studie 4 a 5 byly šestiměsíční studie hodnotící GLYSET při 50 a 100 mg 3krát denně, respektive 100 mg 3krát denně. Ve srovnání s placebem způsobil GLYSET významné snížení HbA1c a významné snížení postprandiální plazmatické glukózy v obou studiích při použitých dávkách.
Tabulka 1 Výsledky studie monoterapie s Glysetem
| Studie | Léčba | HbA1c (%) | 1hodinová postprandiální glukóza (mg / dl) | |
| Průměrná změna oproti základní hodnotě * | Účinek léčby ** | Průměrná změna oproti základní linii | Účinek léčby ** | |
| 1 (USA) | Placebo | +0.71 | +24 | |
| GLYSET 50 mg t.i.d. *** | +0.13 | -0.58†| -39 | -63†|
| 2 (USA) | Placebo | +0.47 | +15 | |
| GLYSET 50 mg t.i.d. | -0.22 | -0.69†| -52 | -67†|
| GLYSET 100 mg t.i.d. | -0.28 | -0.75†| -59 | -74†|
| 3 (bez US). | Placebo | +0.18 | +2 | |
| GLYSET 25 mg t.i.d. | -0.08 | -0.26 | -33 | -35†|
| GLYSET 50 mg t.i.d. | -0.22 | -0.40 | -45 | -47†|
| GLYSET 100 mg t.i.d. | -0.63 | -0.81†| -62 | -64†|
| GLYSET 200 mg t.i.d.C | -0.84 | -1.02†| -85 | -87†|
| 4 (bez US). | Placebo | +0.01 | +8 | |
| GLYSET 50 mg t.i.d. | -0.35 | -0.36†| -20 | -28†|
| GLYSET 100 mg t.i.d. | -0.57 | -0.58†| -25 | -33†|
| 5 (bez US). | Placebo | +0.32 | +17 | |
| GLYSET 100 mg t.i.d. | -0.43 | -0.75†| -38 | -55†|
| * Průměrná základní hodnota se v těchto studiích pohybovala od 7,54 do 8,72%. ** Výsledek odečtení průměru skupiny placeba. *** t.i.d. = 3krát denně †p â ‰ ¤ 0,05 C Ačkoli jsou výsledky 200 mg 3krát denně uváděny pro úplnost, maximální doporučená dávka GLYSETu je 100 mg 3krát denně. |
Klinické zkušenosti u pacientů s NIDDM, kteří dostávají sulfonylmočoviny
GLYSET byl studován jako adjuvantní terapie na pozadí maximální nebo téměř maximální léčby sulfonylmočovinou (SFU) u tří velkých, dvojitě zaslepené, randomizované studie (dvě americké a jedna jiná než U.S.), ve kterých byla hodnocena účinnost u 471 pacientů léčených GLYSET (vidět Tabulka 2).
Studie 6 zahrnovala pacienty léčené maximálními dávkami SFU při vstupu. Na konci této 14týdenní studie byly průměrné léčebné účinky na glykosylovaný hemoglobin (HbA1c) -0,82% a -0,74% u pacientů, kteří dostávají GLYSET 50 mg 3x denně plus SFU, a GLYSET 100 mg 3x denně plus SFU, resp.
Studie 7 byla jednoletá studie, ve které byl GLYSET v dávce 25, 50 nebo 100 mg 3x denně přidán k maximální dávce glyburidu (10 mg dvakrát denně). Na konci této studie se průměrné léčebné účinky na HbA1c GLYSET po přidání k maximálnímu glyburidu terapie byla -0,30%, -0,62% a -0,73% při dávkách GLYSET 25, 50 a 100 mg 3x denně, resp.
Ve studii 8, přidání 100 mg GLYSETu 3krát denně na pozadí ošetření glyburidem vyvolalo další průměrný účinek léčby na HbA1c -0,66%.
Tabulka 2: Výsledky kombinované terapie s GLYSET Plus sulfonylmočovinou (SFU)
| Studie | Léčba | HbA1c (%) | 1hodinová postprandiální glukóza (mg / dl) | |
| Průměrná změna oproti základní hodnotě * | Účinek léčby ** | Průměrná změna oproti základní linii | Účinek léčby ** | |
| 6 (USA) | Placebo + SFU | +0.33 | -1 | |
| GLYSET 50 mg t.i.d. *** + SFU | -0.49 | -0.82†| -69 | -68†|
| GLYSET 100 mg t.i.d. + SFU | -0.41 | -0.74†| -73 | -72†|
| 7 (USA) | Placebo + SFU | +1.01 | 48 | |
| GLYSET 25 mg t.i.d. + SFU | +0.71 | -0.30 | -2 | -50†|
| GLYSET 50 mg t.i.d. + SFU | +0.39 | -0.62†| -13 | -61†|
| GLYSET 100 mg t.i.d. + SFU | +0.28 | -0.73†| -33 | -81†|
| 8 (non-U.S.) | Placebo + SFU | +0.16 | +10 | |
| GLYSET 100 mg t.i.d. + SFU | -0.50 | -0.66†| -36 | -46†|
| * Průměrná výchozí hodnota se v těchto studiích pohybovala od 8,56 do 9,16%. ** Výsledek odečtení průměru skupiny placeba. *** t.i.d. = 3krát denně â € p â ‰ ¤ 0,05 |
Odezva na dávku
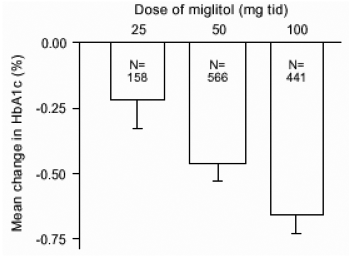
Výsledky z kontrolovaných studií s fixními dávkami přípravku Glyset jako monoterapie nebo kombinační léčby se sulfonylmočovinou byly spojeny, aby se získal souhrnný odhad. rozdílu oproti placebu v průměrné změně glykosylované hemoglobinu (HbA1c) a glukózy v plazmě po jídle, jak je ukázáno na obrázcích 1 a 2, oproti výchozí hodnotě:
Obrázek 1: HbA1c (%) průměrná změna oproti základní linii: Výsledky léčby spojené s výsledky studií kontrolovaných dávek v tabulkách 1 a 2
Obrázek 2: 1hodinová postprandiální plazmatická glukóza průměrná změna od výchozí hodnoty: Výsledky léčby spojené výsledky ze studií kontrolovaných pevných dávek v tabulkách 1 a 2
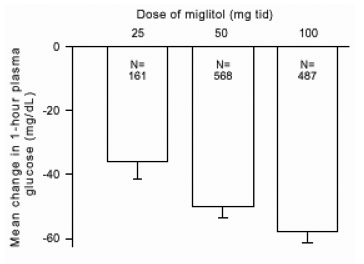
Vzhledem ke svému mechanismu účinku se primární farmakologický účinek miglitolu projevuje jako snížení postprandiální plazmatické glukózy, jak bylo ukázáno dříve ve všech hlavních klinických studiích. GLYSET se statisticky významně lišil od placeba ve všech dávkách v každé jednotlivé studii s ohledem na účinek průměrná hodinová postprandiální plazmatická glukóza a pro tuto účinnost existuje dávka od 25 do 100 mg 3krát denně parametr.
horní
Indikace a použití
Glyset tablety, jako monoterapie, jsou indikovány jako doplněk stravy ke zlepšení glykemické kontroly u pacienti s diabetes mellitus nezávislým na inzulínu (NIDDM), jejichž hyperglykémii nelze zvládnout dieta sama. Glyset lze také použít v kombinaci se sulfonylmočovinou, pokud dieta plus buď Glyset nebo samotná sulfonylmočovina nevedou k dostatečné glykemické kontrole. Účinek Glysetu ke zvýšení glykemické kontroly je aditivní k účinku sulfonylmočoviny při použití v kombinaci, pravděpodobně proto, že jeho mechanismus účinku je odlišný.
Při zahájení léčby NIDDM by měla být jako primární forma léčby zdůrazněna strava. U obézního diabetika je nezbytné kalorické omezení a úbytek hmotnosti. Správná dietní léčba sama o sobě může být účinná při kontrole hladiny glukózy v krvi a příznaků hyperglykémie. Je třeba také zdůraznit význam pravidelné fyzické aktivity, je-li to vhodné. Pokud tento léčebný program nevede k dostatečné kontrole glykémie, mělo by se zvážit použití přípravku Glyset. Na použití přípravku Glyset musí lékař i pacient nahlížet jako na léčbu kromě stravy a nikoli jako náhradu za stravu nebo jako vhodný mechanismus pro zabránění dietnímu omezení.
horní
Kontraindikace
GLYSET Tablety jsou kontraindikovány u pacientů s:
- Diabetická ketoacidóza
- Zánětlivé onemocnění střev, ulcerace tlustého střeva nebo částečná střevní obstrukce a u pacientů s predispozicí k střevní obstrukci
- Chronická střevní onemocnění spojená s výraznými poruchami trávení nebo absorpce nebo se stavy, které se mohou zhoršovat v důsledku zvýšené tvorby plynu ve střevě
- Přecitlivělost na lék nebo na kteroukoli jeho složku.
horní
Opatření
Všeobecné
Hypoglykémie
Vzhledem ke svému mechanismu účinku by GLYSET, když je podáván samostatně, neměl způsobovat hypoglykémii na lačno nebo postprandiální stav. Sulfonylmočovinová činidla mohou způsobit hypoglykémii. Protože tablety GLYSET podávané v kombinaci se sulfonylmočovinou způsobí další snížení hladiny glukózy v krvi, může to zvýšit hypoglykemický potenciál sulfonylmočoviny, ačkoli to nebylo klinicky pozorováno zkoušky. K léčbě mírné až střední hypoglykémie by měla být místo sacharózy (třtinového cukru) použita orální glukóza (dextróza), jejíž absorpce není zpožděna přípravkem GLYSET. Sacharóza, jejíž hydrolýza na glukózu a fruktózu je inhibována přípravkem GLYSET, je nevhodná pro rychlou korekci hypoglykémie. Těžká hypoglykémie může vyžadovat použití intravenózní infuze glukózy nebo injekce glukagonu.
Ztráta kontroly nad hladinou glukózy v krvi
Pokud jsou diabetičtí pacienti vystaveni stresu, jako je horečka, trauma, infekce nebo chirurgický zákrok, může dojít k dočasné ztrátě kontroly nad hladinou glukózy v krvi. V takových případech může být nutná dočasná inzulínová terapie.
Renální postižení
Plazmatické koncentrace GLYSETu u dobrovolníků s poruchou funkce ledvin byly úměrně zvýšeny v poměru ke stupni renální dysfunkce. Dlouhodobé klinické studie u diabetických pacientů s významnou renální dysfunkcí (sérový kreatinin> 2,0 mg / dl) nebyly provedeny. Proto se léčba těchto pacientů přípravkem GLYSET nedoporučuje.
Informace pro pacienty
Pacientům by měly být poskytnuty následující informace:
- Glyset by měl být užíván perorálně třikrát denně na začátku (s prvním kousnutím) každého hlavního jídla. Je důležité nadále dodržovat dietní pokyny, pravidelný cvičební program a pravidelné testování moči a / nebo krevní glukózy.
- Glyset sám o sobě nezpůsobuje hypoglykémii, ani když se podává pacientům nalačno. Léky na bázi sulfonylmočoviny a inzulín však mohou snížit hladinu cukru v krvi natolik, aby způsobily symptomy nebo někdy život ohrožující hypoglykémii. Protože Glyset podávaný v kombinaci se sulfonylmočovinou nebo inzulínem způsobí další snížení hladiny cukru v krvi, může zvýšit hypoglykemický potenciál těchto látek. Pacienti a odpovědní členové rodiny by měli dobře rozumět riziku hypoglykémie, jejím příznakům a léčbě a stavům, které ji předurčují k jejímu rozvoji. Protože Glyset zabraňuje rozkladu stolního cukru, měl by být zdrojem glukózy (dextróza, D-glukóza) snadno dostupné k léčbě příznaků nízké hladiny cukru v krvi při užívání přípravku Glyset v kombinaci se sulfonylmočovinou nebo inzulín.
- Pokud se u přípravku Glyset objeví vedlejší účinky, obvykle se vyvinou během prvních několika týdnů léčby. Nejčastěji se jedná o mírné až střední gastrointestinální účinky související s dávkou, jako je nadýmání, měkké stolice, průjem nebo nepříjemné pocity v břiše a obvykle se s frekvencí a intenzitou snižují čas. Přerušení léčby obvykle vede k rychlému vymizení těchto gastrointestinálních symptomů.
Laboratorní testy
Terapeutická odpověď na GLYSET může být monitorována periodickými testy na krevní glukózu. Pro monitorování dlouhodobé kontroly glykémie se doporučuje měření hladin glykosylovaného hemoglobinu.
U 12 zdravých mužů souběžně podávaný antacid neovlivnil farmakokinetiku miglitolu.
Lékové interakce
Několik studií zkoumalo možnou interakci mezi miglitolem a glyburidem. U šesti zdravých dobrovolníků byla podána jednorázová dávka 5 mg glyburidu na pozadí 6denní léčby miglitol (50 mg 3krát denně po dobu 4 dnů následovaný 100 mg 3krát denně po dobu 2 dnů) nebo placebo, průměr Cmax a hodnoty AUC pro glyburid byly o 17% a 25% nižší, pokud byl glyburid podáván s miglitolem. Ve studii u diabetických pacientů, ve kterých účinky přidání miglitolu 100 mg 3krát denně po 7 dnech nebo placeba do základního režimu 3,5 mg glyburidu denně byla zkoumána průměrná hodnota AUC glyburidu ve skupině léčené miglitolem o 18% nižší, ačkoli tento rozdíl nebyl statisticky významný. Další informace o možné interakci s glyburidem byly získány z jedné z velkých amerických klinických studií (Studie 7), ve které byla pacientům podávána dávka miglitolu nebo placeba na pozadí glyburidu 10 mg dvakrát denně. Při 6měsíčních a 1letých klinických návštěvách vykazovali pacienti užívající souběžně 100 mg miglitolu 3krát denně průměrnou Cmax hodnoty glyburidu, které byly o 16% a 8% nižší, v porovnání s pacienty užívajícími glyburid samotný. Tyto rozdíly však nebyly statisticky významné. Ačkoli tedy existoval trend směrem k nižším AUC a Cmax hodnoty glyburidu při současném podávání s Glysetem nelze na základě výše uvedených tří studií učinit žádné definitivní prohlášení týkající se potenciální interakce.
U zdravých dobrovolníků byl zkoumán účinek miglitolu (100 mg 3krát denně po 7 dní) na farmakokinetiku jedné dávky 1 000 mg metforminu. Střední AUC a Cmax hodnoty pro metformin byly o 12% až 13% nižší, když dobrovolníci dostali miglitol ve srovnání s placebem, ale tento rozdíl nebyl statisticky významný.
Ve studii se zdravými dobrovolníky bylo současné podávání 50 mg nebo 100 mg miglitolu třikrát denně společně s digoxinem snížily průměrné plazmatické koncentrace digoxinu o 19% a 28%, resp. U diabetických pacientů léčených digoxinem se však koncentrace digoxinu v plazmě nezměnily současným podáváním 100 mg miglitolu 3krát denně po 14 dní.
Další studie se zdravými dobrovolníky prokázaly, že miglitol může významně snížit biologickou dostupnost ranitidinu o 60% a propranololu o 40%. Nebyl pozorován žádný účinek miglitolu na farmakokinetiku ani farmakodynamiku warfarinu ani nifedipinu.
Střevní adsorbenty (např. Dřevěné uhlí) a trávicí enzymové přípravky obsahující enzymy štěpící sacharidy (např. amyláza, pankreatin) mohou snížit účinek Glysetu a neměly by brát souběžně.
U 12 zdravých mužů souběžně podávaný antacid neovlivnil farmakokinetiku miglitolu.
Karcinogeneze, mutageneze a zhoršení plodnosti
Miglitol byl myším podáván dietní cestou v dávkách až přibližně 500 mg / kg tělesná hmotnost (odpovídající více než 5násobku expozice u lidí na základě AUC) po dobu 21 měsíce. Ve dvouleté studii na potkanech byl miglitol podáván ve stravě při expozicích srovnatelných s maximální expozicí člověka na základě AUC. Při dietetické léčbě miglitolem nebyly prokázány žádné karcinogenity.
In vitro bylo zjištěno, že miglitol je nemutagenní v testu bakteriální mutageneze (Ames) a eukaryotickém testu dopředné mutace (CHO / HGPRT). Miglitol nevykazoval žádné klastogenní účinky in vivo v testu na myších mikronukleech. Při dominantním letálním testu nebyly detekovány žádné dědičné mutace.
Kombinovaná studie fertility samců a samic provedená u potkanů Wistar léčených orálně miglitolem v dávkách 300 mg / kg tělesné hmotnosti (přibližně 8násobek maximální expozice člověka na základě plochy povrchu těla) nemělo žádný nepříznivý účinek na reprodukční výkon nebo schopnost reprodukovat. Kromě toho nebylo ohroženo přežití, růst, vývoj a plodnost potomstva.
Těhotenství
Teratogenní účinky
Kategorie těhotenství B
Bezpečnost přípravku GLYSET u těhotných žen nebyla stanovena. Vývojové toxikologické studie byly provedeny na potkanech v dávkách 50, 150 a 450 mg / kg, což odpovídá na úrovně přibližně 1,5, 4 a 12 krát maximální doporučené expozice člověka na základě povrchu těla plocha. U králíků byly zkoumány dávky 10, 45 a 200 mg / kg odpovídající hladinám přibližně 0,5, 3 a 10násobku expozice člověka. Tyto studie neodhalily žádné důkazy o fetálních malformacích, které lze přičíst miglitolu. Dávky miglitolu až 4krát a 3krát vyšší než dávka pro člověka (vztaženo na plochu povrchu těla), u potkanů a králíků, neodhalily známky poškození plodnosti nebo poškození plodu. Nejvyšší dávky testované v těchto studiích, 450 mg / kg u potkanů a 200 mg / kg u králíků podporovaly mateřskou a / nebo fetální toxicitu. Fetotoxicita byla ve studii na potkanech indikována mírným, ale výrazným snížením hmotnosti plodu a mírným snížením hmotnosti hmotnost plodu, opožděná osifikace kostry plodu a zvýšení procenta neživotaschopných plodů králíka studie. V peri-postnatální studii na potkanech byla NOAEL (hladina bez pozorovaného nepříznivého účinku) 100 mg / kg (což odpovídá přibližně čtyřnásobku expozice člověka na základě plochy povrchu těla). Zvýšení mrtvě narozených potomků bylo zaznamenáno při vysoké dávce (300 mg / kg) peri-postnatální krysy studie, ale ne při vysoké dávce (450 mg / kg) v dodacím segmentu vývojové toxicity u potkanů studie. Jinak nedošlo k žádným nepříznivým účinkům na přežití, růst, vývoj, chování nebo plodnost ani ve studiích vývojové toxicity na potkanech ani v peri-postnatálních studiích. Neexistují však dostatečné a dobře kontrolované studie u těhotných žen. Protože studie reprodukce na zvířatech ne vždy predikují lidskou odpověď, mělo by být toto léčivo použito během těhotenství, pouze pokud je to nezbytně nutné.
Kojící matky
Bylo prokázáno, že se Miglitol vylučuje do mateřského mléka ve velmi malé míře. Celkové vylučování do mléka představovalo 0,02% ze 100 mg mateřské dávky. Odhadovaná expozice kojícímu dítěti je přibližně 0,4% mateřské dávky. Přestože hladiny miglitolu dosažené v mateřském mléce jsou mimořádně nízké, doporučuje se, aby přípravek GLYSET nebyl podáván kojící ženě.
Pediatrické použití
Bezpečnost a účinnost přípravku GLYSET u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Z celkového počtu subjektů v klinických studiích s GLYSET ve Spojených státech zahrnovalo pacienty platné pro analýzy bezpečnosti 24% nad 65 a 3% nad 75. Mezi těmito subjekty a mladšími osobami nebyly pozorovány žádné celkové rozdíly v bezpečnosti a účinnosti. Farmakokinetika miglitolu byla studována u starších a mladých mužů (n = 8 na skupinu). Při dávce 100 mg 3x denně po dobu 3 dnů nebyly zjištěny žádné rozdíly mezi oběma skupinami.
horní
Nežádoucí reakce
Gastrointestinální
Gastrointestinální příznaky jsou nejčastějšími reakcemi na GLYSET tablety. V amerických placebem kontrolovaných studiích byl výskyt bolesti břicha, průjmu a nadýmání 11,7%, 28,7% a nadýmání 41,5% v 962 pacienti léčeni GLYSETem 25-100 mg 3x denně, zatímco odpovídající incidence byla 4,7%, 10,0% a 12,0% u 603 placebem léčených pacientů. Výskyt průjmu a bolesti břicha měl při pokračující léčbě značně tendenci se snižovat.
Dermatologický
Kožní vyrážka byla hlášena u 4,3% pacientů léčených přípravkem GLYSET ve srovnání s 2,4% pacientů léčených placebem. Vyrážky byly obecně přechodné a většina z nich byla vyhodnocena lékařskými vyšetřovateli jako nesouvisející s GLYSETem.
Abnormální laboratorní nálezy
Nízké sérové železo se vyskytovalo častěji u pacientů léčených GLYSETem (9,2%) než u pacientů léčených placebem (4,2%), ale ne přetrvávají ve většině případů a nebyly spojeny se snížením hemoglobinu nebo změnami jiných hematologických ukazatelů.
horní
Předávkování
Na rozdíl od sulfonylmočovin nebo inzulínu nebude předávkování GLYSET tablety vést k hypoglykémii. Předávkování může mít za následek přechodné zvýšení nadýmání, průjem a nepohodlí v břiše. Vzhledem k tomu, že u přípravku GLYSET nebyly pozorovány žádné střevní účinky, neočekávají se v případě předávkování žádné závažné systémové reakce.
horní
Dávkování a správa
Pro léčbu diabetes mellitus s přípravkem GLYSET Tablets nebo s jakýmkoli jiným farmakologickým přípravkem není stanoven žádný pevný dávkovací režim. Dávka přípravku GLYSET musí být individualizována na základě účinnosti i tolerance, přičemž nesmí překročit maximální doporučenou dávku 100 mg 3x denně. GLYSET by měl být užíván třikrát denně na začátku (s prvním kousnutím) každého hlavního jídla. Přípravek GLYSET by měl být zahájen dávkou 25 mg a dávkování by se mělo postupně zvyšovat, jak je popsáno níže, aby se snížilo gastrointestinální nepříznivé účinky a umožňující identifikaci minimální dávky potřebné pro odpovídající kontrolu glykémie pacienta.
Během zahájení léčby a titrace dávky (viz níže) může být jedna hodina postprandiální plazmatické glukózy používá se ke stanovení terapeutické odpovědi na GLYSET ak identifikaci minimální účinné dávky pro GLYSET trpěliví. Poté by měl být glykosylovaný hemoglobin měřen v intervalech přibližně tří měsíců. Terapeutickým cílem by mělo být snížení jak postprandiální plazmatické glukózy, tak glykosylovaných hladin hemoglobinu na normální hodnotu nebo téměř normální, při použití nejnižší účinné dávky GLYSET, buď jako monoterapie, nebo v kombinaci se sulfonylmočovinou.
Počáteční dávka
Doporučená počáteční dávka přípravku GLYSET je 25 mg podávaná perorálně třikrát denně na začátku (s prvním kousnutím) každého hlavního jídla. Někteří pacienti však mohou mít prospěch zahájením dávkou 25 mg jednou denně, aby se minimalizovaly gastrointestinální nežádoucí účinky, a postupným zvyšováním frekvence podávání na 3krát denně.
Údržba dávky
Obvyklá udržovací dávka přípravku GLYSET je 50 mg 3krát denně, i když někteří pacienti mohou mít prospěch ze zvýšení dávky na 100 mg 3x denně. Aby se umožnilo přizpůsobení potenciálním gastrointestinálním nepříznivým účinkům, doporučuje se léčba přípravkem GLYSET Iniciován v dávce 25 mg 3krát denně, nejnižší účinná dávka, a poté postupně titrován směrem nahoru, aby to bylo možné přizpůsobování. Po 4 - 8 týdnech 25 mg 3x denně by měla být dávka zvýšena na 50 mg 3x denně přibližně po třech měsících, po kterých by měla být stanovena hladina glykosylovaného hemoglobinu, aby bylo možné posoudit léčbu Odezva. Pokud v té době hladina glykosylovaného hemoglobinu není uspokojivá, může být dávka dále zvýšena na 100 mg 3krát denně, což je maximální doporučená dávka. Souhrnná data z kontrolovaných studií naznačují závislost na dávce jak pro HbA1c, tak po hodinové postprandiální plazmatické glukóze v doporučeném rozmezí dávkování. Žádná jediná studie však nezkoumala účinek glykemické kontroly titrace dávek pacientů v rámci téže studie směrem nahoru. Pokud není pozorováno žádné další snížení hladiny postprandiální glukózy nebo glykosylovaného hemoglobinu při titraci na 100 mg 3krát denně, je třeba zvážit snížení dávky. Jakmile je stanovena účinná a tolerovaná dávka, měla by být zachována.
Maximální dávkování
Maximální doporučená dávka přípravku GLYSET je 100 mg 3krát denně. V jedné klinické studii 200 mg 3krát denně poskytlo další zlepšenou kontrolu glykémie, ale zvýšilo výskyt výše popsaných gastrointestinálních symptomů.
Pacienti, kteří dostávají sulfonylmočoviny
Sulfonylmočovinová činidla mohou způsobit hypoglykémii. U pacientů, kteří užívali přípravek GLYSET v kombinaci se sulfonylureou, nedošlo ke zvýšenému výskytu hypoglykémie ve srovnání s výskytem hypoglykémie u pacientů, kteří dostávali sulfonylmočoviny samostatně v jakémkoli klinickém stavu soud.
GLYSET podávaný v kombinaci se sulfonylmočovinou však způsobí další snížení hladiny glukózy v krvi a může zvýšit riziko hypoglykémie v důsledku aditivních účinků těchto dvou látek. Dojde-li k hypoglykémii, je třeba upravit dávkování těchto látek.
horní
Jak se dodává
Tablety GLYSET jsou dostupné ve formě bílých kulatých potahovaných tablet 25 mg, 50 mg a 100 mg. Tablety jsou vyraženy slovem „GLYSET“ na jedné straně a silou na druhé straně, jak je uvedeno níže.
| Síla | NDC | Identifikace tabletu | |
| Přední | Zadní | ||
| Lahve po 100: | |||
| 25 mg | 0009-5012-01 | GLYSET | 25 |
| 50 mg | 0009-5013-01 | GLYSET | 50 |
| 100 mg | 0009-5014-01 | GLYSET | 100 |
Skladujte při 25 ° C (77 ° F); dovolené odchylky od 15 ° -30 ° C (viz teplota regulovaná USP).
Pouze Rx

Vyrobeno:
Bayer HealthCare AG
Leverkusen, Německo
Glyset je registrovaná ochranná známka společnosti Bayer HealthCare Pharmaceuticals Inc používaná na základě licence.
LAB-0167-6.0
naposledy aktualizováno 05/2008
Glyset, miglitol, informace o pacientech (v prosté angličtině)
Podrobné informace o příznacích, příznacích, příčinách, léčbě cukrovky
Účelem informací v této monografii není pokrýt všechna možná použití, pokyny, preventivní opatření, lékové interakce nebo nepříznivé účinky. Tyto informace jsou zobecněné a neslouží jako zvláštní lékařská pomoc. Máte-li dotazy týkající se léků, které užíváte, nebo byste chtěli získat více informací, obraťte se na svého lékaře, lékárníka nebo zdravotní sestru.
zpět k: Procházet všechny léky na cukrovku



