Kompletní informace o předepisování Iloperidonu (fanapt)
Název značky: Fanapt
Obecný název: Iloperidon
Fanapt (Iloperidone) Příručka pro předepisování (PDF)
Obsah:
Varování v krabici
Indikace a použití
Dávkování a správa
Kontraindikace
Varování a bezpečnostní opatření
Nežádoucí reakce
Lékové interakce
Použití ve specifických populacích
Zneužívání drog a závislost
Předávkovat
Popis
Klinická farmakologie
Neklinická toxikologie
Klinické studie
Jak dodáván
Průvodce léky Brintellix
VAROVÁNÍ: ZVÝŠENÁ MORTALITA U DĚTSKÝCH PACIENTŮ S PSYCHÓZOU Dementní
U starších pacientů s psychózou související s demencí léčených antipsychotiky je zvýšené riziko úmrtí. FANAPT není schválen pro léčbu pacientů s psychózou související s demencí.
Indikace a použití
FANAPT® je indikován k léčbě schizofrenie u dospělých.
Při rozhodování mezi alternativními léčbami, které jsou k dispozici pro tento stav, by měl předepisující lékař zvážit zjištění, že FANAPT je spojen s prodloužením intervalu QTc. Prodloužení intervalu QTc je spojeno s některými dalšími léky se schopností způsobit torsade de arytmie typu pointes, potenciálně fatální polymorfní komorová tachykardie, která může vést k náhlým smrt. V mnoha případech by to vedlo k závěru, že první léky by měly být vyzkoušeny jako první. Dosud není známo, zda FANAPT způsobí torsade de pointes nebo zvýší míru náhlé smrti.
Pacienti musí být titrováni na účinnou dávku FANAPT. Proto může být kontrola příznaků zpožděna během prvních 1 až 2 týdnů léčby ve srovnání s některými jinými antipsychotiky, které nevyžadují podobnou titraci. Předepisující lékaři by měli mít na paměti toto zpoždění při výběru antipsychotika k léčbě schizofrenie.
pokračujte v příběhu níže
Dávkování a správa
Obvyklá dávka
FANAPT musí být titrován pomalu od nízké počáteční dávky, aby se zabránilo ortostatické hypotenzi kvůli jeho alfa-adrenergním blokovacím vlastnostem. Doporučená počáteční dávka pro tablety FANAPT je 1 mg perorálně dvakrát denně. Může být provedeno zvýšení dávky, aby bylo dosaženo cílového rozmezí 6 - 12 mg dvakrát denně (12_24 mg / den), s úpravou denní dávky nepřesahující 2 mg dvakrát denně (4 mg / den). Maximální doporučená dávka je 12 mg dvakrát denně (24 mg / den). Dávky FANAPT nad 24 mg / den nebyly v klinických studiích systematicky hodnoceny. Účinnost byla prokázána u přípravku FANAPT v rozmezí dávek 6 až 12 mg dvakrát denně. Předepisující lékaři by měli mít na paměti, že pacienti musí být titrováni na účinnou dávku FANAPTU. Proto může být kontrola příznaků zpožděna během prvních 1 až 2 týdnů léčby ve srovnání s některými jinými antipsychotiky, které nevyžadují podobnou titraci. Předepisující lékaři by si rovněž měli být vědomi toho, že některé nežádoucí účinky spojené s užíváním FANAPTu závisejí na dávce. FANAPT lze podávat bez ohledu na jídlo.
Dávkování ve zvláštních souborech
Úprava dávky u pacientů užívajících současně FANAPT s potenciálními inhibitory CYP2D6: dávka FANAPT by měla být při současném podávání se silnými inhibitory CYP2D6, jako je fluoxetin nebo paroxetin, snížena o polovinu. Pokud je inhibitor CYP2D6 vyřazen z kombinované terapie, dávka FANAPT by měla být zvýšena na původní hodnotu.
Úprava dávky u pacientů užívajících současně FANAPT s potenciálními inhibitory CYP3A4: Dávka FANAPT by měla být při současném podání se silnými inhibitory CYP3A4, jako je ketokonazol nebo klaritromycin. Pokud je inhibitor CYP3A4 vysazen z kombinované terapie, dávka FANAPT by měla být zvýšena na původní úroveň.
Úprava dávky u pacientů užívajících FANAPT, kteří jsou špatnými metabolizátory CYP2D6: Dávka FANAPT by měla být snížena o polovinu u špatných metabolizátorů CYP2D6.
Poškození jater: U pacientů s mírným poškozením jater není nutná úprava dávky FANAPTu. U pacientů se středně těžkou poruchou funkce jater může být požadováno snížení dávky, pokud je to klinicky indikováno. FANAPT se nedoporučuje u pacientů se závažným poškozením jater.
Údržba léčby
V dlouhodobější studii byl přípravek FANAPT účinný ve zpoždění doby do relapsu u pacientů se schizofrenií, kteří byli stabilizováni na FANAPT až na 24 mg / den. Pacienti by měli být pravidelně přehodnocováni, aby bylo možné určit potřebu udržovací léčby.
Opětovné zahájení léčby u pacientů, kteří byli dříve vysazeni Přestože neexistují žádné údaje, které by specificky řešily opětovné zahájení léčby při léčbě se doporučuje dodržet plán zahájení titrace, kdykoli mají pacienti interval delší než FANAPT než 3 dny.
horní
Dávkové formy a silné stránky
Tablety FANAPT jsou k dispozici v následujících silách: 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg a 12 mg. Tablety jsou bílé, kulaté, ploché, se zkosenými hranami a označené logem „“ vyraženým na jedné straně a silou tablety „1“, „2“, „4“, „6“, „8“, „10“, nebo „12“ na druhé straně.
horní
Kontraindikace
FANAPT je kontraindikován u osob se známou reakcí přecitlivělosti na přípravek. Byly hlášeny anafylaxe, angioedém a další reakce přecitlivělosti.
horní
VAROVÁNÍ A OPATŘENÍ
Zvýšená úmrtnost starších pacientů s psychózou související s demencí
Antipsychotika zvyšují riziko úmrtí ze všech příčin u starších pacientů s psychózou související s demencí. Analýzy 17 placebem kontrolovaných studií s psychózou souvisejících s demencí (modální trvání 10 týdnů a převážně u pacientů užívajících atypické antipsychotika) odhalila riziko úmrtí u pacientů léčených léky v rozmezí 1,6 až 1,7násobku rizika u pacientů léčených placebem. V průběhu typické 10týdenní kontrolované studie byla míra úmrtnosti u pacientů léčených drogami přibližně 4,5% ve srovnání s mírou přibližně 2,6% u pacientů léčených placebem.
Ačkoli příčiny smrti byly různé, většina úmrtí se zdála být buď kardiovaskulární (např. Srdeční selhání, náhlá smrt) nebo infekční (např. Pneumonie) v přírodě. FANAPT není schválen pro léčbu pacientů s psychózou související s demencí.
Cerebrovaskulární nežádoucí reakce, včetně mrtvice, u starších pacientů s psychózou související s demencí
V placebem kontrolovaných studiích u starších jedinců s demencí byli pacienti randomizováni do risperidonu, aripiprazol a olanzapin měly vyšší výskyt mrtvice a přechodného ischemického záchvatu, včetně fatálních mrtvice. FANAPT není schválen pro léčbu pacientů s psychózou související s demencí.
Prodloužení QT
V otevřené studii QTc u pacientů se schizofrenií nebo schizoafektivní poruchou (n = 160) byl FANAPT spojen s prodloužením QTc o 9 ms při dávce iloperidonu 12 mg dvakrát denně. Účinek FANAPT na QT interval byl zvýšen přítomností metabolické inhibice CYP450 2D6 nebo 3A4 (paroxetin 20 mg jednou denně a ketokonazol 200 mg dvakrát denně). Za podmínek metabolické inhibice jak pro 2D6, tak pro 3A4 byl FANAPT 12 mg dvakrát denně spojen s průměrným zvýšením QTcF od výchozí hodnoty asi 19 ms.
Během klinického programu před uvedením na trh nebyly pozorovány žádné případy torsade de pointes ani jiné závažné srdeční arytmie.
Použití FANAPT by se nemělo používat v kombinaci s jinými léky, o nichž je známo, že prodlužují QTc, včetně třídy 1A (např. Chinidin, prokainamid). nebo antiarytmická léčiva třídy III (např. amiodaron, sotalol), antipsychotika (např. chlorpromazin, thioridazin), antibiotika (např. gatifloxacin, moxifloxacin) nebo jakoukoli jinou třídu léků, o kterých je známo, že prodlužují QTc interval (např. pentamidin, levomethadyl acetát, methadon). FANAPT by se také nemělo u pacientů s vrozeným syndromem dlouhé QT au pacientů s anamnézou srdečních arytmií.
Některé okolnosti mohou zvýšit riziko torsade de pointes a / nebo náhlé smrti ve spojení s užíváním léčiv, která prodlužují QTc interval, včetně (1) bradykardie; (2) hypokalémie nebo hypomagneziémie; (3) současné užívání jiných léků, které prodlužují QTc interval; a (4) přítomnost vrozeného prodloužení QT intervalu; (5) nedávný akutní infarkt myokardu; a / nebo (6) nekompenzované srdeční selhání.
Při předepisování přípravku FANAPT léky, které inhibují metabolismus FANAPT, au pacientů se sníženou aktivitou CYP2D6 je nutná opatrnost.
Doporučuje se, aby pacienti, kteří jsou zvažováni pro léčbu FANAPTem, byli ohroženi významnými poruchy elektrolytu mají základní hladiny draslíku a hořčíku v séru s periodickými monitorování. Hypokalémie (a / nebo hypomagneziémie) může zvýšit riziko prodloužení QT a arytmie. U pacientů s anamnézou významného kardiovaskulárního onemocnění, např. QT, by se nemělo předcházet FANAPT prodloužení, nedávný akutní infarkt myokardu, nekompenzované srdeční selhání nebo srdeční arytmie. FANAPT by měl být vysazen u pacientů, u kterých bylo zjištěno, že mají trvalé QTc měření> 500 ms.
Pokud se u pacientů užívajících FANAPT objeví příznaky, které by mohly naznačovat výskyt srdečních arytmií, např. závratě, palpitace nebo synkopa, by měl předepisující lékař zahájit další vyšetření, včetně srdečního monitorování.
Neuroleptický maligní syndrom (NMS)
Potenciálně fatální symptomový komplex někdy označovaný jako neuroleptický maligní syndrom (NMS) byl hlášen v souvislosti s podáváním antipsychotik, včetně FANAPT. Mezi klinické projevy patří hyperpyrexie, rigidita svalů, změněný duševní stav (včetně katatonických příznaků) a důkaz autonomní nestability (nepravidelný puls nebo krevní tlak, tachykardie, diaforéza a srdeční frekvence) dysrytmie). Další příznaky mohou zahrnovat zvýšenou kreatinfosfokinázu, myoglobinurii (rabdomyolýzu) a akutní selhání ledvin. Diagnostické hodnocení pacientů s tímto syndromem je komplikované. Při stanovení diagnózy je důležité identifikovat případy, v nichž klinická prezentace zahrnuje závažné zdravotní onemocnění a neléčené nebo nedostatečně ošetřené extrapyramidové příznaky a symptomy (EPS). Mezi další důležité aspekty v diferenciální diagnostice patří centrální anticholinergní toxicita, úpal, horečka léčiva a patologie primárního centrálního nervového systému (CNS).
Řízení tohoto syndromu by mělo zahrnovat: (1) okamžité vysazení antipsychotik a dalších léků, které nejsou nezbytné pro současnou terapii, (2) intenzivní symptomatická léčba a lékařské monitorování a (3) léčba všech současných závažných zdravotních problémů, pro které jsou k dispozici specifické léčby. Neexistuje obecná shoda ohledně specifických farmakologických léčebných režimů pro NMS.
Pokud pacient po zotavení z NMS vyžaduje antipsychotickou léčbu, je třeba pečlivě zvážit potenciální opětovné zavedení lékové terapie. Pacient by měl být pečlivě sledován, protože byly hlášeny recidivy NMS.
Tardivní dyskineze
Tardivní dyskineze je syndrom sestávající z potenciálně ireverzibilních, nedobrovolných, dyskinetických pohybů, které se mohou vyvinout u pacientů léčených antipsychotiky. Přestože se výskyt syndromu jeví jako nejvyšší mezi staršími, zejména staršími ženami, není možné spoléhají na odhady prevalence, aby na počátku antipsychotické léčby předpověděly, u kterých pacientů se pravděpodobně bude syndrom. Není známo, zda se antipsychotické léčivé přípravky liší svým potenciálem způsobit tardivní dyskinezi.
Předpokládá se riziko rozvoje tardivní dyskineze a pravděpodobnost, že se stane nevratnou ke zvýšení v průběhu léčby a celkové kumulativní dávce podaného antipsychotika zvyšuje. Syndrom se však může vyvíjet, i když mnohem méně často, po relativně krátkém období léčby při nízkých dávkách.
Neexistuje žádná známá léčba pro prokázané případy tardivní dyskineze, ačkoli syndrom může remitovat, částečně nebo úplně, pokud je antipsychotická léčba ukončena. Samotná antipsychotická léčba však může potlačit (nebo částečně potlačit) příznaky a symptomy syndromu, a tím může maskovat základní proces. Účinek, který má symptomatická suprese na dlouhodobý průběh syndromu, není znám.
Vzhledem k těmto úvahám by měl být FANAPT předepsán způsobem, který s největší pravděpodobností minimalizuje výskyt tardivní dyskineze. Chronická antipsychotická léčba by měla být obecně vyhrazena pro pacienty, kteří trpí chronickým onemocněním, o kterém je známo, že (1) reaguje antipsychotika a (2) pro které nejsou dostupné alternativní, stejně účinné, ale potenciálně méně škodlivé léčby nebo odpovídající. U pacientů, kteří vyžadují chronickou léčbu, je třeba hledat co nejmenší dávku a nejkratší dobu léčby, která vede k uspokojivé klinické odpovědi. Potřeba pokračovat v léčbě by měla být pravidelně přehodnocována.
Pokud se u pacienta na FANAPT objeví známky a příznaky tardivní dyskineze, mělo by se zvážit přerušení léčby. Někteří pacienti však mohou vyžadovat léčbu FANAPTem navzdory přítomnosti syndromu.
Metabolické změny
Atypická antipsychotika jsou spojována s metabolickými změnami, které mohou zvyšovat kardiovaskulární / cerebrovaskulární riziko. Tyto metabolické změny zahrnují hyperglykémii, dyslipidemii a nárůst tělesné hmotnosti. I když se ukázalo, že všechna atypická antipsychotika způsobují určité metabolické změny, každé léčivo ve třídě má svůj specifický rizikový profil.
Hyperglykémie a diabetes mellitus
U pacientů léčených atypickými antipsychotiky včetně FANAPT byla hlášena hyperglykémie, v některých případech extrémní a spojená s ketoacidózou nebo hyperosmolární kómou nebo smrtí. Posouzení vztahu mezi atypickým antipsychotickým užíváním a abnormalitami glukózy je komplikováno možností zvýšení riziko pozadí diabetes mellitus u pacientů se schizofrenií a zvyšující se výskyt diabetes mellitus obecně populace. Vzhledem k těmto zmatkům není vztah mezi atypickým antipsychotickým užíváním a nežádoucími účinky spojenými s hyperglykémií zcela objasněn. Epidemiologické studie však naznačují zvýšené riziko nežádoucích účinků souvisejících s hyperglykémií u pacientů léčených atypickými antipsychotiky zahrnutými v těchto studiích.
Pacienti se stanovenou diagnózou diabetes mellitus, kteří začínají s atypickými antipsychotiky, by měli být pravidelně sledováni, aby se zhoršila kontrola glukózy. Pacienti s rizikovými faktory pro diabetes mellitus (např. Obezita, rodinná anamnéza diabetu), kteří začínají s léčbou atypická antipsychotika by měla být podrobena testování glykémie nalačno na začátku léčby a pravidelně během ní léčba. U každého pacienta léčeného atypickými antipsychotiky je třeba sledovat příznaky hyperglykémie včetně polydipsie, polyurie, polyfágie a slabosti. Pacienti, u kterých se během léčby atypickými antipsychotiky vyvinou příznaky hyperglykémie, by se měli podrobit glykémii nalačno. V některých případech hyperglykémie ustoupila, když byla atypická antipsychotika vysazena; nicméně někteří pacienti vyžadovali pokračování antidiabetické léčby i přes přerušení podezřelého léčiva.
Údaje ze čtyřtýdenní studie s pevnou dávkou u dospělých jedinců se schizofrenií, ve kterých byly odebrány vzorky krve nalačno, jsou uvedeny v tabulce 1.
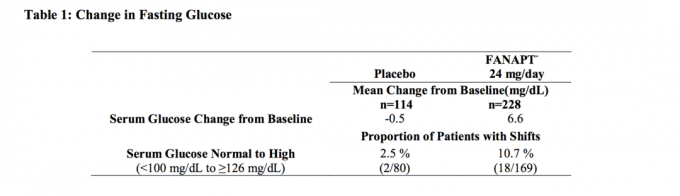
Souhrnné analýzy údajů o glukóze z klinických studií, včetně dlouhodobějších studií, jsou uvedeny v tabulce 2.
Dyslipidémie
U pacientů léčených atypickými antipsychotiky byly pozorovány nežádoucí změny lipidů.
Údaje z placebem kontrolovaného čtyřtýdenního studu s pevnou dávkou, ve kterém byly odebrány vzorky krve nalačno, u dospělých jedinců se schizofrenií jsou uvedeny v tabulce 3.

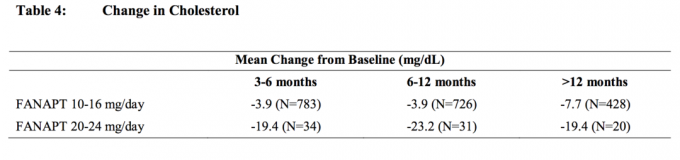
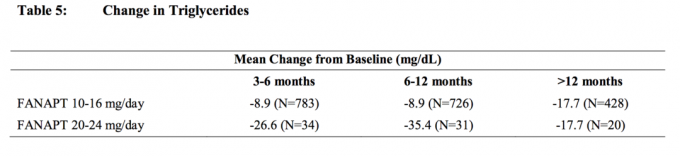
Souhrnné analýzy údajů o cholesterolu a triglyceridech z klinických studií, včetně dlouhodobějších studií, jsou uvedeny v tabulce 4 a tabulce 5.
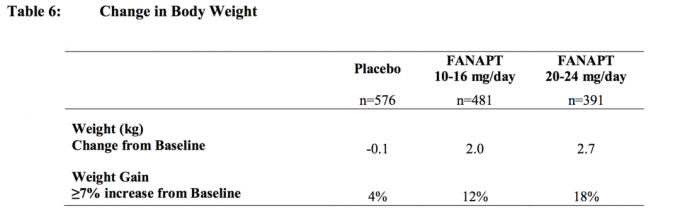
Přibývání na váze
Při atypickém antipsychotickém použití byl pozorován nárůst tělesné hmotnosti. Doporučuje se klinické sledování hmotnosti.
Ve všech krátkodobých a dlouhodobých studiích byla celková průměrná změna oproti výchozímu stavu v koncovém bodě 2,1 kg.
Změny tělesné hmotnosti (kg) a podíl subjektů se zvýšením tělesné hmotnosti o> 7% od 4 placebem kontrolované, 4 nebo 6 týdnů, studie s pevnou nebo flexibilní dávkou u dospělých subjektů jsou uvedeny v Tabulka 6.
Záchvaty
V krátkodobých placebem kontrolovaných studiích (4 až 6 týdnů) se záchvaty vyskytly u 0,1% (1/1344) pacientů léčených FANAPTem ve srovnání s 0,3% (2/587) u placeba. Stejně jako u jiných antipsychotik by měl být přípravek FANAPT používán opatrně u pacientů s záchvaty v anamnéze nebo se stavy, které potenciálně snižují práh záchvatů. Podmínky, které snižují práh záchvatu, mohou být častější u populace ve věku 65 let a starší.
Ortostatická hypotenze a synkopa
FANAPT může vyvolat ortostatickou hypotenzi spojenou se závratěmi, tachykardií a synkopou. To odráží jeho alfa1-adrenergní antagonistické vlastnosti. Ve dvojitě slepých placebem kontrolovaných krátkodobých studiích, kde byla dávka zvyšována pomalu, podle doporučení výše byla synkopa hlášena u 0,4% (5/1344) pacientů léčených FANAPTem ve srovnání s 0,2% (1/587) placebo. Ortostatická hypotenze byla hlášena u 5% pacientů, kteří dostávali 20-24 mg / den, 3% pacientů, kteří dostávali 10-16 mg / den, a 1% pacientů, kterým bylo podáváno placebo. Očekává se, že rychlejší titrace zvýší rychlost ortostatické hypotenze a synkopy.
FANAPT by měl být používán s opatrností u pacientů se známým kardiovaskulárním onemocněním (např. Srdeční selhání, anamnéza infarktu myokardu, ischemie nebo vedení) abnormality), cerebrovaskulárním onemocněním nebo stavy, které předisponují pacienta k hypotenzi (dehydrataci, hypovolémii a léčbě antihypertenzivem) léky). U pacientů, kteří jsou náchylní k hypotenze, by mělo být zváženo sledování ortostatických životních funkcí.
Leukopenie, neutropenie a agranulocytóza
V klinických studiích a postmarketingových zkušenostech byly hlášeny případy leukopenie / neutropenie dočasně související s antipsychotiky. Byla také hlášena agranulocytóza (včetně fatálních případů).
Možné rizikové faktory leukopenie / neutropenie zahrnují již existující nízký počet bílých krvinek (WBC) a anamnézu leukopenie / neutropenie v anamnéze. U pacientů s již existující nízkou WBC nebo anamnézou leukopenie / neutropenie v anamnéze by měla být sledována jejich kompletní krevní obraz (CBC) často během prvních několika měsíců léčby a měla by přerušit FANAPT při prvních známkách poklesu WBC v nepřítomnosti jiných původců faktory.
Pacienti s neutropenií by měli být pečlivě sledováni na horečku nebo jiné příznaky nebo známky infekce a měli by být okamžitě léčeni, pokud k těmto příznakům nebo projevům dojde. Pacienti s těžkou neutropenií (absolutní počet neutrofilů <1 000 / mm3) by měli FANAPT přerušit a nechat sledovat jejich WBC až do zotavení.
Hyperprolaktinémie
Stejně jako u jiných léků, které antagonizují dopaminové D2 receptory, zvyšuje FANAPT hladiny prolaktinu.
Hyperprolaktinémie může potlačit hypotalamický GnRH, což má za následek sníženou sekreci gonadotropinu hypofýzy. To zase může inhibovat reprodukční funkci tím, že zhoršuje gonadalsteroidogenezi u žen i mužů. U sloučenin zvyšujících prolaktin byla hlášena galaktorea, amenorea, gynekomastie a impotence. Dlouhodobá hyperprolaktinémie spojená s hypogonadismem může vést ke snížení hustoty kostí u žen i mužů.
Experimenty s tkáňovými kulturami ukazují, že přibližně jedna třetina lidských rakovin prsu je in vitro závislá na prolaktinu, a faktor potenciálního významu, pokud se předpokládá předepisování těchto léků u pacienta s dříve detekovanou prsou rakovina. U myší a potkanů léčených FANAPT byly pozorovány proliferativní změny a zvýšení prolaktinu v séru. Ani klinické studie ani epidemiologické studie provedené doposud neprokázaly souvislost mezi chronickým podáváním této třídy léčiv a tumorigenezí u lidí; dostupné důkazy jsou v současné době považovány za příliš omezené na to, aby byly přesvědčivé.
V krátkodobé placebem kontrolované studii (4 týdny) byla průměrná změna plazmatických hladin prolaktinu ze základní hodnoty do cílového bodu ve skupině léčené FANAPTem 24 mg / den bylo zvýšení o 2,6 ng / ml ve srovnání se snížením o 6,3 ng / ml v placebo skupina. V této studii byly pozorovány zvýšené hladiny prolaktinu v plazmě u 26% dospělých léčených FANAPTem ve srovnání s 12% ve skupině s placebem. V krátkodobých studiích byl FANAPT spojen se skromnými hladinami zvýšení prolaktinu ve srovnání s větším zvýšením prolaktinu pozorovaným u některých jiných antipsychotik. V souhrnné analýze z klinických studií, včetně dlouhodobějších studií, u 3210 dospělých léčených iloperidonem byla gynekomastie hlášena u 2 mužů (0,1%) ve srovnání s 0% u pacientů léčených placebem a galaktorea byla hlášena u 8 žen (0,2%) ve srovnání se 3 ženami (0,5%) u placebem léčených pacientů.
Regulace tělesné teploty
Antipsychotikům byla přičítána narušení schopnosti těla snižovat teplotu těla. Při předepisování FANAPTU pacientům, kteří zažijí stavy, které mohou přispět ke zvýšení tělesného jádra, se doporučuje náležitá péče teplota, např. namáhavé cvičení, vystavení extrémnímu teplu, příjem souběžné medikace s anticholinergní aktivitou nebo vystavení dehydratace.
Dysfagie
S užíváním antipsychotik je spojena dysmotilita jícnu a aspirace. Aspirační pneumonie je běžnou příčinou morbidity a mortality u starších pacientů. FANAPT a jiná antipsychotika by se měla používat opatrně u pacientů s rizikem aspirační pneumonie.
Sebevražda
Možnost pokusu o sebevraždu je spojena s psychotickým onemocněním a protidrogová terapie by měla být doprovázena pečlivým dohledem vysoce rizikových pacientů. Předpisy pro FANAPT by měly být psány pro nejmenší množství tablet, které je v souladu s dobrým léčením pacientů, aby se snížilo riziko předávkování.
Priapismus
V předobchodním programu FANAPT byly hlášeny tři případy priapizmu. Bylo hlášeno, že léky s alfa-adrenergními blokujícími účinky vyvolávají priapizmus. FANAPT sdílí tuto farmakologickou aktivitu. Těžký priapizmus může vyžadovat chirurgický zásah.
Potenciál kognitivních a motorických poruch
FANAPT, stejně jako jiná antipsychotika, má potenciál narušit úsudek, myšlení nebo motorické dovednosti. V krátkodobých placebem kontrolovaných studiích byla ospalost (včetně sedace) hlášena u 11,9% (104/874) dospělí pacienti léčení přípravkem FANAPT v dávkách 10 mg / den nebo vyšších proti 5,3% (31/587) léčených placebo. Pacienti by měli být obeznámeni s obsluhou nebezpečných strojů, včetně automobilů, dokud si nejsou zcela jisti, že terapie FANAPTem na ně nepříznivě neovlivňuje.
horní
Nežádoucí reakce
Zkušenosti z klinických studií
Protože klinické zkoušky jsou prováděny za velmi proměnlivých podmínek, je v klinickém hodnocení léčiva pozorována míra nežádoucích účinků nelze přímo srovnávat s mírami v klinických studiích s jiným léčivem a nemusí odrážet míry pozorované v klinických studiích praxe. Níže uvedené informace jsou odvozeny z databáze klinických studií pro FANAPT sestávající z 3229 pacientů vystavených FANAPT v dávkách 10 mg / den nebo vyšších pro léčbu schizofrenie. Z toho 999 dostalo FANAPT po dobu nejméně 6 měsíců, přičemž 657 bylo vystaveno FANAPT po dobu nejméně 12 měsíců. Všichni tito pacienti, kteří dostali FANAPT, se účastnili klinických studií s více dávkami. Podmínky a trvání léčby přípravkem FANAPT se značně lišily a zahrnovaly (v překrývajících se kategoriích), otevřené a dvojitě zaslepené fáze studií, hospitalizace a ambulance, studie s pevnou a flexibilní dávkou a krátkodobé a dlouhodobé expozice.
Informace uvedené v těchto oddílech byly odvozeny ze souhrnných údajů ze 4 placebem kontrolovaných, čtyř nebo šesti týdnů, studie s pevnou nebo flexibilní dávkou u pacientů, kteří dostávali FANAPT v denních dávkách v rozmezí 10 až 24 mg (n = 874).
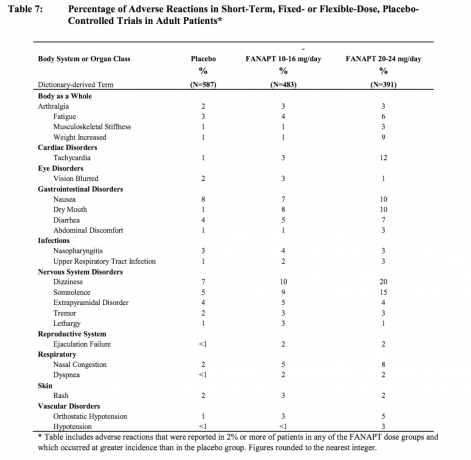
Nežádoucí reakce, které se vyskytují při výskytu 2% nebo více u pacientů léčených FANAPT a častější než u placeba
Tabulka 7 uvádí souhrnný výskyt nežádoucích účinků, které byly spontánně hlášeny u čtyř placebem kontrolovaných, čtyř nebo šest týdnů, studie s pevnou nebo flexibilní dávkou, seznam těch reakcí, které se vyskytly u 2% nebo více pacientů léčených přípravkem FANAPT v jakékoli dávce skupiny, u kterých byl výskyt u pacientů léčených FANAPT v jakékoli dávkové skupině větší než výskyt u pacientů léčených placebo.
Nežádoucí reakce související s dávkou v klinických pokusech
Na základě souhrnných údajů ze 4 placebem kontrolovaných, 4- nebo 6-týdenních studií s pevnou nebo flexibilní dávkou byly nežádoucí účinky, které se vyskytly u více než 2% incidence u pacientů léčených FANAPTem, u nichž byla incidence u pacientů léčených FANAPTem 20-24 mg / den dvakrát vyšší než incidence u pacienti léčeni přípravkem FANAPT 10 -16 mg / den byli: břišní diskomfort, závratě, hypotenze, muskuloskeletální ztuhlost, tachykardie a hmotnost zvýšil.
Časté a lékové nežádoucí účinky v klinických hodnoceních
Na základě souhrnných údajů ze 4 placebem kontrolovaných, 4- nebo 6týdenních studií s pevnou nebo flexibilní dávkou se u léčených pacientů vyskytly následující nežádoucí účinky při ≥ 5% incidenci s FANAPT a nejméně dvakrát placebem potkanem po dobu alespoň 1 dávky: závratě, sucho v ústech, únava, nosní kongesce, somnolence, tachykardie, ortostatická hypotenze a hmotnost zvýšil. Zvýšení závratě, tachykardie a hmotnosti byly nejméně 20krát častější při 20-24 mg / den než při 10-16 mg / den.
Extrapyramidové příznaky (EPS) v klinických zkouškách
Shromážděné údaje ze 4 placebem kontrolovaných, čtyř nebo šestitýdenních studií s pevnou nebo flexibilní dávkou, poskytly informace týkající se EPS. Data o nepříznivých událostech shromážděná z těchto studií ukázala následující míry nežádoucích účinků souvisejících s EPS, jak je uvedeno v tabulce 8.

Nežádoucí účinky spojené s ukončením léčby v klinických hodnoceních
Na základě souhrnných údajů ze 4 placebem kontrolovaných, 4- nebo 6-týdenních, fixních nebo flexibilních studií o dávce nebyla žádná rozdíl ve výskytu přerušení léčby z důvodu nežádoucích účinků mezi léčenými FANAPTem (5%) a placebem (5%) pacientů. Typy nežádoucích účinků, které vedly k přerušení léčby, byly u pacientů léčených FANAPTem a placebem podobné.
Demografické rozdíly v nežádoucích reakcích v klinických pokusech
Vyšetření populačních podskupin ve 4 placebem kontrolovaných, 4 nebo 6 týdnů, fixních nebo studie o flexibilních dávkách neodhalily žádné důkazy o rozdílech v bezpečnosti na základě věku, pohlaví nebo rasy.
Abnormality laboratorních testů v klinických pokusech
Mezi FANAPTem a placebem nebyly žádné rozdíly v incidenci přerušení léčby v důsledku změn v hematologii, analýze moči nebo chemii séra.
V krátkodobých placebem kontrolovaných studiích (4 až 6 týdnů) bylo 1,0% (13/1342) pacientů léčených iloperidonem s hematokrit alespoň jednou pod rozšířeným normálním rozsahem během post randomizační léčby, ve srovnání s 0,3% (2/585) při placebo. Rozšířený normální rozsah pro snížený hematokrit byl definován v každé z těchto pokusů jako hodnota 15% pod normálním rozsahem pro centralizovanou laboratoř, která byla použita v pokusu.
Další reakce během předobchodního hodnocení FANAPT
Následuje seznam termínů MedDRA, které odrážejí nežádoucí účinky u pacientů léčených přípravkem FANAPT ve více dávkách ≥ 4 mg / den během kterékoli fáze pokusu s databází 3210 léčených FANAPTem pacientů. Zahrnuty jsou všechny hlášené reakce s výjimkou těch, které jsou již uvedeny v tabulce 7, nebo jiných částí nežádoucích účinků (6), které jsou uvedeny v Varování a bezpečnostní opatření (5), ty reakční termíny, které byly tak obecné, že byly neinformativní, reakce hlášené u méně než 3 pacientů a které nebyly závažné ani život ohrožující, reakce, které jsou jinak běžné jako reakce na pozadí, a reakce považované za nepravděpodobné, že by byly drogy příbuzný.
Reakce jsou dále rozděleny do tříd orgánových systémů MedDRA a jsou seřazeny podle klesající frekvence podle následujícího definice: časté nežádoucí účinky jsou ty, které se vyskytují nejméně u 1/100 pacientů (v tomto se objevují pouze ty, které nejsou uvedeny v tabulce 7) seznam); vzácné nežádoucí účinky jsou ty, které se vyskytují u 1/100 až 1/1000 pacientů; vzácné jevy vyskytující se u méně než 1/1000 pacientů.
Poruchy krve a lymfatického systému: Vzácné - anémie, anémie z nedostatku železa; Vzácné – leukopenie
Srdeční poruchy: Časté - palpitace; Vzácné - arytmie, atrioventrikulární blok prvního stupně, srdeční selhání (včetně městnavého a akutního)
Poruchy ucha a labyrintu: Vzácné –vertigo, tinnitus
Endokrinní poruchy: Vzácné - hypotyreóza
Poruchy oka: Časté - zánět spojivek (včetně alergie); Zřídka - suché oko, blefaritida, otoky očních víček, otoky očí, opacity čoček, katarakta, hyperémie (včetně spojivky)
Gastrointestinální poruchy: Vzácné - gastritida, hypersekrece slin, fekální inkontinence, vředy v ústech; Vzácné - aftózní stomatitida, dvanáctníkový vřed, hiátová kýla, hyperchlorhydrie, ulcerace rtů, refluxní ezofagitida, stomatitida
Obecné poruchy a administrativní podmínky na místě: Vzácný - edém (obecně, pitting, kvůli srdeční chorobě), potíže při chůzi, žízně; Vzácné - hypertermie
Poruchy jater a žlučových cest: Vzácné - cholelitiáza
Vyšetření: Časté: snížená hmotnost; Zřídka - hemoglobin se snížil, počet neutrofilů se zvýšil, hematokrit se snížil
Poruchy metabolismu a výživy: Vzácné - zvýšená chuť k jídlu, dehydratace, hypokalémie, retence tekutin
Poruchy svalové a kosterní soustavy a pojivové tkáně: časté - myalgie, svalové křeče; Vzácné - torticollis
Poruchy nervového systému: Občasné - parestézie, psychomotorická hyperaktivita, neklid, amnézie, nystagmus; Syndrom vzácných neklidných nohou
Psychiatrické poruchy: Časté - neklid, agrese, klam; Zřídka - nepřátelství, snížené libido, paranoia, anorgasmie, stav zmatenosti, mánie, katatonie, výkyvy nálad, panika útok, obsedantně-kompulzivní porucha, bulimie nervosa, delirium, polydipsie psychogenní, porucha kontroly impulsu, hlavní Deprese
Poruchy ledvin a močových cest: Časté - močová inkontinence; Zřídka - dysurie, pollakiurie, enuréza, nefrolitiáza; Vzácné - retence moči, akutní selhání ledvin
Poruchy reprodukčního systému a prsu: Časté - erektilní dysfunkce; Infrequen - bolest varlat, amenorea, bolest prsu; Vzácné - menstruace nepravidelná, gynekomastie, menorágie, metrorrhagie, postmenopauzální krvácení, prostatitida.
Respirační, hrudní a mediastinální poruchy: Vzácné - epistaxe, astma, rinorrhea, sinusová kongesce, suchost v nosu; Vzácné - sucho v krku, syndrom spánkové apnoe, namáhání dušnosti
Zkušenosti po uvedení na trh
Následující nežádoucí účinky byly zjištěny při použití přípravku FANAPT po schválení: retrográdní ejakulace a reakce přecitlivělosti (včetně anafylaxe; angioedém; těsnost v krku; orofaryngeální otok; otok obličeje, rtů, úst a jazyka; kopřivka; vyrážka; a svědění). Protože tyto reakce byly hlášeny dobrovolně z populace nejisté velikosti, není možné spolehlivě odhadnout jejich frekvenci nebo stanovit příčinnou souvislost s expozicí léčivu.
horní
Lékové interakce
Vzhledem k primárním účinkům FANAPT na CNS je třeba postupovat opatrně, pokud je užíván v kombinaci s jinými centrálně působícími drogami a alkoholem. Díky antagonismu alfa1-adrenergních receptorů má FANAPT potenciál zvýšit účinek určitých antihypertenziv.
Potenciál dalších léčiv ovlivnit FANAPT
Iloperidon není substrátem pro enzymy CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 nebo CYP2E1. To naznačuje, že interakce iloperidonu s inhibitory nebo induktory těchto enzymů nebo jinými faktory, jako je kouření, je nepravděpodobná. CYP3A4 i CYP2D6 jsou zodpovědné za metabolismus iloperidonu. Inhibitory CYP3A4 (např. Ketokonazol) nebo CYP2D6 (např. Fluoxetin, paroxetin) mohou inhibovat eliminaci iloperidonu a způsobit zvýšené hladiny v krvi.
Ketokonazol: Současné podávání ketokonazolu (200 mg dvakrát denně po dobu 4 dnů), účinného inhibitoru CYP3A4, s jednorázovou dávkou iloperidonu 3 mg na 19 zdraví dobrovolníci ve věku 18–45 let, zvětšili plochu pod křivkou (AUC) iloperidonu a jeho metabolitů P88 a P95 o 57%, 55% a 35%, resp. Dávky Iloperidonu by měly být sníženy asi o polovinu, pokud jsou podávány s ketokonazolem nebo jinými silnými inhibitory CYP3A4 (např. Itrakonazol). Slabší inhibitory (např. Erytromycin, grapefruitová šťáva) nebyly studovány. Pokud je inhibitor CYP3A4 vysazen z kombinované terapie, měla by být dávka iloperidonu vrácena na předchozí úroveň.
Fluoxetin: Současné podávání fluoxetinu (20 mg dvakrát denně po dobu 21 dnů), účinného inhibitoru CYP2D6, s jednorázovou dávkou 3 mg iloperidonu 23 zdravým dobrovolníkům ve věku 29–44 let, kteří byli klasifikováni jako extenzivní metabolisté CYP2D6, zvýšili AUC iloperidonu a jeho metabolitu P88 asi 2- až 3krát a snížili AUC jeho metabolitu P95 o jedna polovina. Dávky Iloperidonu by se měly snížit o polovinu, pokud se podávají s fluoxetinem. Pokud je fluoxetin vysazen z kombinované terapie, měla by být dávka iloperidonu vrácena na předchozí úroveň. Očekává se, že jiné silné inhibitory CYP2D6 budou mít podobné účinky a budou vyžadovat odpovídající snížení dávky. Když je inhibitor CYP2D6 vysazen z kombinované terapie, může být dávka iloperidonu zvýšena na předchozí úroveň.
Paroxetin: Souběžné podávání paroxetinu (20 mg / den po dobu 5-8 dnů), účinného inhibitoru CYP2D6, s opakovanými dávkami iloperidonu (8) nebo 12 mg dvakrát denně) u pacientů se schizofrenií ve věku 18–65 let vedlo ke zvýšení průměrné maximální koncentrace v ustáleném stavu iloperidon a jeho metabolit P88, asi 1,6krát, a snížily průměrné maximální koncentrace v rovnovážném stavu svého metabolitu P95 o jedna polovina. Dávky Iloperidonu by měly být při podávání s paroxetinem sníženy o polovinu. Pokud je paroxetin vysazen z kombinované terapie, měla by být dávka iloperidonu vrácena na předchozí úroveň. Očekává se, že jiné silné inhibitory CYP2D6 budou mít podobné účinky a budou vyžadovat odpovídající snížení dávky. Když je inhibitor CYP2D6 vysazen z kombinované terapie, může být dávka iloperidonu zvýšena na předchozí úroveň.
Paroxetin a ketokonazol: Souběžné podávání paroxetinu (20 mg jednou denně po dobu 10 dnů), inhibitoru CYP2D6 a ketokonazolu (200 mg) dvakrát denně) při opakovaných dávkách iloperidonu (8 nebo 12 mg dvakrát denně) pacientům se schizofrenií ve věku 18–65 let vedlo k 1,4 násobné zvýšení koncentrací iloperidonu a jeho metabolitu P88 v ustáleném stavu a 1,4násobné snížení koncentrace P95 v přítomnosti paroxetin. Takže podávání iloperidonu s inhibitory obou jeho metabolických drah nepřispělo k účinku žádného inhibitoru podávaného samostatně. Dávky Iloperidonu by proto měly být sníženy přibližně o polovinu, pokud jsou podávány současně s inhibitory CYP2D6 a CYP3A4.
Potenciál FANAPT ovlivnit jiné drogy
Studie in vitro na lidských jaterních mikrozomech ukázaly, že iloperidon podstatně neinhibuje metabolismus léky metabolizované následujícím izozymem cytochromu P450: CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9 nebo CYP2E1. Kromě toho studie in vitro na lidských jaterních mikrozomech ukázaly, že iloperidon nemá enzym indukující vlastnosti, konkrétně pro následující izozymy cytochromu P450: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP3A4 a CYP3A5.
Dextrometorfan: Studie na zdravých dobrovolnících ukázala, že změny ve farmakokinetice dextrometorfanu (dávka 80 mg) při dávce 3 mg Souběžné podávání iloperidonu vedlo k 17% zvýšení celkové expozice a 26% zvýšení maximální plazmatické koncentrace Cmax dextromethorfan. Interakce mezi iloperidonem a jinými substráty CYP2D6 je tedy nepravděpodobná.
Fluoxetin: Jedna 3mg dávka iloperidonu neměla žádný vliv na farmakokinetiku fluoxetinu (20 mg dvakrát denně).
Midazolam (citlivý substrát CYP 3A4): Studie u pacientů se schizofrenií prokázala méně než 50% zvýšení celkového midazolamu expozice v ustáleném stavu iloperidonu (14 dnů po perorálním podání až 10 mg iloperidonu dvakrát denně) a žádný účinek na midazolam C max. Interakce mezi iloperidonem a jinými substráty CYP3A4 je tedy nepravděpodobná.
Léky, které prodlužují QT interval FANAPT by neměly být používány s jinými léky, které prodlužují QT interval.
horní
Použití ve specifických populacích
Registr expozice těhotenství
Existuje registr těhotenské expozice, který sleduje těhotenské výsledky u žen vystavených FANAPT během těhotenství. Pro více informací kontaktujte Národní registr těhotenství pro atypická antipsychotika na 1-866-961-2388 nebo navštivte http://womensmentalhealth.org/clinical-and -vyhledávací programy / těhotenství /.
Souhrn rizik
Novorozenci, jejichž matky jsou vystaveny antipsychotikům, včetně FANAPT, během třetího trimestru těhotenství, jsou po porodu vystaveni extrapyramidovým a / nebo abstinenčním příznakům. Omezená dostupná data s FANAPTem u těhotných žen nestačí k tomu, aby bylo možné informovat o rizicích spojených s závažnými vrozenými vadami a potratem spojenými s drogami. Iloperidon nebyl teratogenní při perorálním podání těhotným potkanům během organogeneze v dávkách až 26násobku maximální doporučené dávky pro člověka 24 mg / den na mg / m2. Prodloužilo se však trvání těhotenství a porodu, zvýšilo se počet narozených mrtvých, časné intrauterinní úmrtí, zvýšil se výskyt zpoždění vývoje a snížilo přežití štěňat po porodu. Iloperidon nebyl teratogenní při perorálním podání těhotným králíkům během organogeneze v dávkách až 20krát s MRHD na bázi mg / m2. Zvýšil však časné intrauterinní úmrtí a snížil životaschopnost plodu v době nejvyšší dávky, která byla také toxickou dávkou pro matku.
Riziko pozadí velkých vrozených vad a potratů u uvedené populace není známo. U americké populace je odhadované riziko pozadí velkých vrozených vad a potratů u klinicky uznaných těhotenství 2-4%, respektive 15-20%.
Klinické úvahy
Fetální / novorozenecké nežádoucí reakce
Extrapyramidové a / nebo abstinenční příznaky, včetně agitace, hypertonie, hypotonie, třesu, somnolence, respiračních potíží a u novorozenců, jejichž matky byly vystaveny antipsychotikům během třetího trimestru v roce 2006, byly hlášeny poruchy výživy těhotenství. Tyto příznaky se lišily závažností. Někteří novorozenci se zotavili během několika hodin nebo dnů bez zvláštního ošetření; jiní vyžadovali delší hospitalizaci. Sledujte novorozence na extrapyramidové a / nebo abstinenční příznaky a náležitě je léčte.
Data
Údaje o zvířatech
Ve studii embryofetálního vývoje byly gravidním potkanům podány 4, 16 nebo 64 mg / kg / den (1,6, 6,5 a 26krát maximální doporučená dávka pro člověka (MRHD) 24 mg / den (na základě mg / m2) iloperidonu perorálně během období organogeneze. Nejvyšší dávka způsobila zvýšenou časnou intrauterinní smrt, sníženou hmotnost a délku plodu, snížená osifikace skeletu plodu a zvýšený výskyt menších skeletálních anomálií plodu a variace; tato dávka také způsobila sníženou spotřebu potravy pro matky a přibývání na váze.
Ve studii embryofetálního vývoje byly těhotným králíkům podány iloperidon 4, 10 nebo 25 mg / kg / den (3, 8 a 20násobek MRHD na mg / m2) během období organogeneze. Nejvyšší dávka způsobila zvýšené časné intrauterinní úmrtí a sníženou životaschopnost plodu v době; tato dávka také způsobila mateřskou toxicitu.
V dalších studiích, ve kterých byly potkanům podávány iloperidon v dávkách podobných výše uvedeným, počínaje před počátkem nebo od 17. den těhotenství a pokračování po odstavení, zvýšené nepříznivé reprodukční účinky zahrnovaly prodloužené těhotenství a porod míra porodu, zvýšený výskyt viscerálních změn plodu, snížená hmotnost plodu a mláďat a snížené porodnické mládě přežití. Na neurobehaviorální nebo reprodukční vývoj přežívajících mláďat nedošlo. Dávky bez účinku se pohybovaly od 4 do 12 mg / kg, s výjimkou zvýšení počtu porodů, ke kterému došlo při nejnižší testované dávce 4 mg / kg, což je 1,6násobek MRHD na základě mg / m2. V těchto studiích byla při vyšších dávkách pozorována mateřská toxicita.
Iloperidonový metabolit P95, který je hlavním cirkulujícím metabolitem iloperidonu u lidí, ale není přítomen v signifikantní množství u potkanů, bylo podáno těhotným potkanům během organogeneze při perorálních dávkách 20, 80 nebo 200 mg kg / den. Nebyly pozorovány žádné teratogenní účinky. Při všech dávkách došlo ke zpožděné kostní osifikaci. Nebyla vyvolána žádná významná mateřská toxicita. Plazmatické hladiny P95 (AUC) při nejvyšší testované dávce byly 2krát vyšší než u lidí, kteří dostávali MRHD iloperidonu.
Laktace
Souhrn rizik
Neexistují žádné informace týkající se přítomnosti iloperidonu nebo jeho metabolitů v mateřském mléce, účinky iloperidonu na kojené dítě ani účinky iloperidonu na lidské mléko Výroba. Iloperidon je přítomen v krysím mléce. Vzhledem k možnému výskytu závažných nežádoucích účinků u kojených dětí, upozorněte ženu během léčby přípravkem FANAPT na kojení.
Data Přenos radioaktivity do mléka kojících potkanů byl zkoumán po jedné dávce [14C] iloperidonu v 5 mg / kg. Koncentrace radioaktivity v mléce 4 hodiny po dávce byla přibližně 10krát vyšší než koncentrace v plazmě ve stejnou dobu. Do 24 hodin po podání však koncentrace radioaktivity v mléce klesly na hodnoty mírně nižší než plazma. Metabolický profil v mléce byl kvalitativně podobný profilu v plazmě.
Použití u dětí Bezpečnost a účinnost u dětských a dospívajících pacientů nebyla stanovena.
Geriatrické použití
Klinické studie FANAPT v léčbě schizofrenie nezahrnovaly dostatečný počet pacientům ve věku 65 let a více, aby určili, zda reagují odlišně než mladší dospělí pacientů. Z 3210 pacientů léčených přípravkem FANAPT v premarketingových studiích bylo 25 (0,5%) ve věku ≥65 let a nebyli žádní pacienti ve věku ≥75 let.
Starší pacienti s psychózou související s demencí, kteří byli léčeni FANAPTem, mají ve srovnání s placebem zvýšené riziko úmrtí. FANAPT není schválen pro léčbu pacientů s psychózou související s demencí.
Renální postižení
Protože FANAPT je vysoce metabolizován a méně než 1% léčiva se vylučuje v nezměněné podobě, není pravděpodobné, že by poškození ledvin mělo významný dopad na farmakokinetiku FANAPT. Poškození ledvin (clearance kreatininu <30 ml / min) mělo minimální účinek na Cmax iloperidonu (podávaného v jedné dávce 3 mg) a jeho metabolitů P88 a P95 v kterémkoli z měřených 3analytů. AUC0– ∞ byla u subjektů s poškozením ledvin zvýšena o 24%, snížena o 6% a zvýšena o 52% pro iloperidon, P88 a P95.
Jaterní postižení
U pacientů s mírným poškozením jater není nutná úprava dávky FANAPTu. U pacientů se středně těžkou poruchou funkce jater může být nutné snížit dávku. FANAPT se nedoporučuje u pacientů se závažným poškozením jater.
U dospělých jedinců s mírným poškozením jater nebyl ve srovnání se zdravými dospělými kontrolami pozorován žádný významný rozdíl ve farmakokinetice iloperidonu, P88 nebo P95 (celkový nebo nevázaný). U subjektů se středně těžkou poruchou funkce jater byla vyšší (2krát) a variabilnější volná expozice aktivním metabolitům P88 pozorované ve srovnání se zdravými kontrolami, zatímco expozice iloperidonu a P95 byla obecně podobná (méně než 50% změna ve srovnání s řízení). Protože studie u pacientů se závažným poškozením jater nebyla provedena, FANAPT se nedoporučuje u pacientů se závažným poškozením jater.
Stav kouření
Na základě in vitro studií využívajících lidské jaterní enzymy není FANAPT substrátem pro CYP1A2; kouření by proto nemělo mít vliv na farmakokinetiku FANAPT.
Těhotenství
horní
Zneužívání drog a závislost
Řízená látka
FANAPT není kontrolovaná látka.
Zneužívání
FANAPT nebyl systematicky studován na zvířatech nebo lidech z důvodu jeho možného zneužití, tolerance nebo fyzické závislosti. Přestože klinické studie neodhalily žádnou tendenci k chování při hledání drog, tato pozorování nebyla systematická a není to možné na základě této zkušenosti předpovídat, do jaké míry bude léčivo aktivní na CNS, FANAPT, zneužito, odkloněno a / nebo zneužito jednou prodává. Pacienti by proto měli být pečlivě vyšetřeni na anamnézu zneužívání drog a měli by být pozorně sledujte známky zneužití nebo zneužití FANAPT (např. vývoj tolerance, zvýšení dávky, vyhledávání léků) chování).
horní
Předávkování
Lidské zkušenosti
V pre-marketingových studiích zahrnujících více než 3210 pacientů došlo k náhodnému nebo úmyslnému předávkování přípravkem FANAPT dokumentováno u 8 pacientů v rozmezí od 48 mg do 576 mg užívaných najednou a 292 mg užívaných během 3 dnů doba. Z těchto případů nebyly hlášeny žádné úmrtí. Největší potvrzené jednorázové požití FANAPT bylo 576 mg; u tohoto pacienta nebyly zaznamenány žádné nepříznivé fyzikální účinky. Dalším největším potvrzeným příjmem FANAPT bylo 438 mg během 4 dnů; U tohoto pacienta byly zaznamenány extrapyramidové příznaky a interval QTc 507 ms, bez srdečních následků. Tento pacient obnovil léčbu FANAPTem dalších 11 měsíců.
Obecně byly hlášenými známkami a příznaky ty, které jsou výsledkem nadsázky známých farmakologických účinků (např. Ospalost a sedace, tachykardie a hypotenze) FANAPT.
Řízení předávkování
Pro FANAPT neexistuje žádné specifické antidotum. Proto by měla být zavedena vhodná podpůrná opatření. V případě akutního předávkování by měl lékař zřídit a udržovat dýchací cesty a zajistit odpovídající okysličení a ventilaci. Je třeba zvážit výplach žaludku (po intubaci, pokud je pacient v bezvědomí) a podávání aktivního uhlí spolu s projímadlem. Možnost tření, záchvatů nebo dystonických reakcí hlavy a krku po předávkování může způsobit aspirace s indukovaným zvracením. Kardiovaskulární monitorování by mělo být zahájeno okamžitě a mělo by zahrnovat nepřetržité monitorování EKG pro detekci možných arytmií. Pokud je podávána antiarytmická terapie, neměly by se používat disopyramid, prokainamid a chinidin, protože mají potenciál pro prodloužení QT intervalu, který by mohl být aditivní k účinkům FANAPTu. Podobně je rozumné očekávat, že alfa-blokující vlastnosti bretylia mohou být aditivní k vlastnostem FANAPT, což vede k problematické hypotenzi. Hypotenze a krevní oběh by měly být léčeny vhodnými opatřeními, jako jsou intravenózní tekutiny nebo sympatomimetika (epinefrin a dopamin by se neměly používat, protože stimulace beta může zhoršit hypotenzi v nastavení alfa indukovaného FANAPTem blokáda). V případě závažných extrapyramidových příznaků by měla být podávána anticholinergní léčba. Pečlivý lékařský dohled by měl pokračovat, dokud se pacient nezotaví.
horní
Popis
FANAPT je atypická antipsychotika patřící do chemické třídy derivátů piperidinylbenzisoxazolu. Jeho chemický název je 4 '- [3- [4- (6-fluor-1,2-benzisoxazol-3-yl) piperidino] propoxy] -3'-methoxyacetofenon. Jeho molekulový vzorec je C24H27FN2O4 a jeho molekulová hmotnost je 426,48. Strukturální vzorec je:
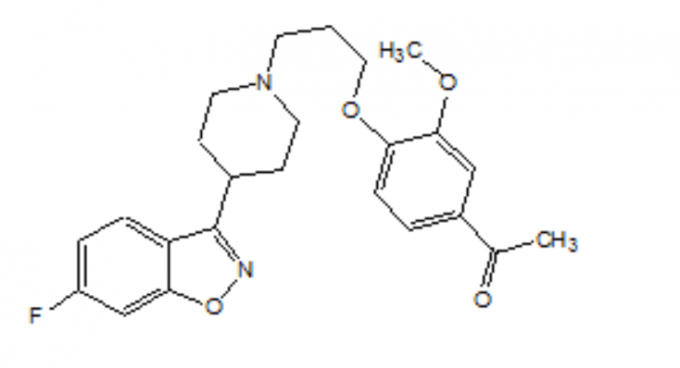
Iloperidon je bílý až téměř bílý jemně krystalický prášek. Je prakticky nerozpustný ve vodě, velmi slabě rozpustný v 0,1 N HC1 a volně rozpustný v chloroformu, ethanolu, methanolu a acetonitrilu.
Tablety FANAPT jsou určeny pouze k perorálnímu podání. Každé kolo bez povlaku
tableta obsahuje 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg nebo 12 mg iloperidonu. Neaktivní složky jsou: monohydrát laktózy, mikrokrystalická celulóza, hydroxypropylmethylcelulóza, krospovidon, stearát hořečnatý, koloidní křemík
oxid a čištěná voda (odstraněna během zpracování). Tablety jsou bílé, kulaté, ploché, se zkosenými hranami a označené logem „“ vyraženým na jedné straně a silou tablety „1“, „2“, „4“, „6“, „8“, „10“, nebo „12“ na druhé straně.
horní
Klinická farmakologie
Mechanismus účinku
Mechanismus účinku iloperidonu u schizofrenie není znám. Účinnost iloperidonu by však mohla být zprostředkována kombinací antagonismu dopaminu typu 2 (D2) a serotoninu typu 2 (5-HT2).
Iloperidon tvoří aktivní metabolit P88, který má vazebný profil in vitro podobný mateřskému léčivu.
Farmakodynamika
Iloperidon působí jako antagonista s vysokou (nM) afinitní vazbou na serotoninový 5-HT2A dopamin D2 a Receptory D3 a receptory norepinefrinu NEal (hodnoty Ki 5,6, 6,3, 7,1 a 0,36 nM, ). Iloperidon má střední afinitu k dopaminovým D4 a serotoninovým 5-HT6 a 5-HT7 receptorům (hodnoty Ki 25, 43 a 22, nM a) nízká afinita k serotoninovým 5-HT1A, dopaminovým D1 a histaminovým H1 receptorům (hodnoty Ki 168, 216 a 437 nM, ). Iloperidon nemá znatelnou afinitu (Ki> 1000 nM) pro cholinergní muskarinové receptory. Afinita iloperidonového metabolitu P88 je obecně stejná nebo menší než afinita mateřské sloučeniny, zatímco metabolit P95 je pouze vykazuje afinitu k 5-HT2A (hodnota Ki 3,91) a NEa1A, NEalB, NEalD a NEa2C receptory (hodnoty Ki 4,7, 2,7, 8,8 a 4,7 nM) ).
Farmakokinetika
Pozorovaný průměrný eliminační poločas iloperidonu, P88 a P95 u extenzivních metabolizátorů CYP2D6 (EM) jsou 18, 26 a 23 hodin, a ve špatných metabolizátorech (PM) 33, 37 a 31 hodin. Koncentrace v ustáleném stavu se dosáhne během 3 až 4 dnů po podání. Hromadění iloperidonu je předvídatelné z farmakokinetiky jedné dávky. Farmakokinetika iloperidonu je více než úměrná dávce. Eliminace iloperidonu je hlavně hepatickým metabolismem zahrnujícím 2 P450 izozymy, CYP2D6 a CYP3A4.
Absorpce: Iloperidon se dobře vstřebává po podání tablety, přičemž maximální plazmatické koncentrace se objevují během 2 až 4 hodin; zatímco relativní biologická dostupnost tabletové formulace ve srovnání s perorálním roztokem je 96%. Podávání iloperidonu se standardním jídlem s vysokým obsahem tuků nemělo významný vliv na Cmax nebo AUC iloperidonu, P88 nebo P95, ale oddálil Tmax o 1 hodinu pro iloperidon, 2 hodiny pro P88 a 6 hodin pro P95. FANAPT lze podávat bez ohledu na jídlo.
Distribuce: Iloperidon má zjevnou clearance (clearance / biologická dostupnost) 47 až 102 l / h, se zjevným distribučním objemem 1340 - 2800 L. Při terapeutických koncentracích je nevázaná frakce iloperidonu v plazmě ~ 3% a každého metabolitu (P88 a P95) je ~ 8%.
Metabolismus a eliminace: Iloperidon je metabolizován primárně 3 biotransformačními cestami: redukcí karbonylu, hydroxylací (zprostředkovaná CYP2D6) a O-demetylací (zprostředkovaná CYP3A4). Existují 2 převládající metabolity iloperidonu, P95 a P88. Metabolit iloperidonu P95 představuje 47,9% AUC iloperidonu a jeho metabolitů v plazmě v ustáleném stavu u extenzivních metabolizátorů (EM) a 25% u špatných metabolizátorů (PM). Aktivní metabolit P88 představuje 19,5% a 34,0% celkové plazmatické expozice v EM a PM.
Přibližně 7% - 10% Kavkazanů a 3% - 8% černochů / afrických Američanů nemá schopnost metabolizovat CYP2D6 substráty a jsou klasifikovány jako špatné metabolizátory (PM), zatímco ostatní jsou střední, rozsáhlé nebo ultrarapidové metabolizátory. Souběžné podávání FANAPT se známými silnými inhibitory CYP2D6, jako je fluoxetin, vede k 2,3násobnému zvýšení zvýšení plazmatické expozice iloperidonu, a proto by měla být polovina dávky FANAPTu spravováno.
Podobně mají PM CYP2D6 vyšší expozici iloperidonu ve srovnání s EM a PM by měla být jejich dávka snížena o polovinu. K dispozici jsou laboratorní testy pro identifikaci PM CYP2D6.
Převážná část radioaktivních materiálů byla získána v moči (průměr 58,2%, respektive 45,1% v EM a PM), přičemž výkaly představovaly 19,9% (EM) až 22,1% (PM) podané radioaktivity.
Interakce transportéru: Iloperidon a P88 nejsou substráty P-gp a iloperidon je slabý inhibitor P-gp.
horní
Neklinická toxikologie
Karcinogeneze, mutageneze, zhoršení plodnosti
Karcinogeneze: Byly provedeny studie celoživotní karcinogenity u myší CD-1 a potkanů Sprague Dawley. Iloperidon byl orálně podáván v dávkách 2,5, 5,0 a 10 mg / kg / den myším CD-1 a 4, 8 a 16 mg / kg / den do Krysy Sprague Dawley (0,5, 1,0 a 2,0 krát a 1,6, 3,2 a 6,5 krát, MRHD 24 mg / den na mg / m2) základ). U samic myší léčených pouze nejnižší dávkou (2,5 mg / kg / den) byl zvýšený výskyt maligních nádorů mléčné žlázy. U potkanů nedošlo k žádnému zvýšení neoplazie souvisejícímu s léčbou.
Karcinogenní potenciál metabolitu iloperidonu P95, který je hlavním cirkulujícím metabolitem iloperidonu u lidí, ale není přítomen ve významném množství u myší nebo krysy, byla hodnocena v celoživotní studii karcinogenity u potkanů Wistar při perorálních dávkách 25, 75 a 200 mg / kg / den u samců a 50, 150 a 250 (sníženo ze 400) mg / kg / den u ženy. K neoplastickým změnám souvisejícím s léčivem došlo u mužů, v hypofýze (pars distalis adenoma) ve všech dávkách a ve slinivce břišní (adenom buněk ostrůvků) při vysoké dávce. Plazmatické hladiny P95 (AUC) u mužů při testovaných dávkách (25, 75 a 200 mg / kg / den) byly přibližně 0,4, 3, respektive 23krát, expozice člověka P95 při MRHD iloperidonu.
Mutageneze: Iloperidon byl negativní v Amesově testu a in vivo mikronukleárním testech na kostní dřeni a potkaních játrech in vivo. Iloperidonem indukované chromozomální aberace v buňkách vaječníků čínského křečka (CHO) in vitro v koncentracích, které také způsobovaly určitou cytotoxicitu.
Metabolit iloperidonu P95 byl negativní v testu Ames, testu chromozomové aberace V79 a testu mikronukleu myší kostní dřeně in vivo.
Snížení plodnosti: Iloperidon snížil plodnost ve 12 a 36 mg / kg ve studii, ve které byly léčeny jak samce, tak samice potkanů. Dávka bez účinku byla 4 mg / kg, což je 1,6násobek MRHD 24 mg / den na základě mg / m2.
horní
Klinické studie
Účinnost přípravku FANAPT při léčbě schizofrenie byla podpořena 2 placebem a aktivně kontrolované krátkodobé (4- a 6-týdenní) studie a jedna dlouhodobá randomizovaná placebem kontrolovaná studie výběrové řízení. Do všech studií byli zařazeni pacienti, kteří splnili kritéria DSM-III / IV pro schizofrenii.
V těchto studiích byly použity tři nástroje pro hodnocení psychiatrických příznaků a symptomů. Měřítko pozitivního a negativního syndromu (PANSS) a Brief Psychiatric Rating Scale (BPRS) jsou soupisy více položek.
obecné psychopatologie obvykle používané k vyhodnocení účinků lékové léčby u schizofrenie. Hodnocení klinického globálního zobrazení (CGI) odráží dojem zkušeného pozorovatele, který je plně obeznámen s projevy schizofrenie, o celkovém klinickém stavu pacienta.
Šestidenní, placebem kontrolovaná studie (n = 706) zahrnovala 2 flexibilní rozsahy dávek FANAPT (12-16 mg / den nebo 20-24 mg / den) ve srovnání s placebem a aktivní kontrolou (risperidon). Pro skupinu 12-16 mg / den byl plán titrace FANAPT 1 mg dvakrát denně ve dnech 1 a 2, 2 mg dvakrát denně ve dnech 3 a 4, 4 mg dvakrát denně ve dnech 5 a 6 a 6 mg dvakrát denně v den 7. Pro skupinu 20-24 mg / den byl plán titrace FANAPT 1 mg dvakrát denně v den 1, 2 mg dvakrát denně v den 2, 4 mg dvakrát denně v den 3, 6 mg dvakrát denně ve dnech 4 a 5, 8 mg dvakrát denně v den 6 a 10 mg dvakrát denně v den 7. Primárním koncovým bodem byla změna od výchozí hodnoty v celkovém skóre BPRS na konci léčby (den 42). Jak rozmezí dávek 12-16 mg / den, tak 20-24 mg / den FANAPT byly lepší než placebo v celkovém skóre BPRS. Účinná kontrolní antipsychotika se v této studii v prvních dvou pokusech jevila lepší než FANAPT týdny, zjištění, které může být částečně vysvětleno rychlejší titrací, která k tomu byla možná lék. U pacientů v této studii, kteří zůstali v léčbě po dobu nejméně 2 týdnů, se zdálo, že iloperidon má srovnatelnou účinnost jako aktivní kontrola.
Čtyřtýdenní placebem kontrolovaná studie (n = 604) zahrnovala jednu fixní dávku FANAPT (24 mg / den) ve srovnání s placebem a aktivní kontrolu (ziprasidon). Titrační plán pro tuto studii byl podobný jako u 6týdenní studie. Tato studie zahrnovala titraci FANAPT počínaje 1 mg dvakrát denně v den 1 a zvyšováním na 2, 4, 6, 8, 10 a 12 mg dvakrát denně ve dnech 2, 3, 4, 5, 6 a 7. Primárním koncovým bodem byla změna oproti základní hodnotě celkového skóre PANSS na konci léčby (den 28). Dávka FANAPT 24 mg / den byla lepší než placebo v celkovém skóre PANSS. Ukázalo se, že FANAPT má podobnou účinnost jako aktivní kontrolní léčivo, které také vyžaduje pomalou titraci jako cílová dávka.
V dlouhodobější studii klinicky stabilní dospělí ambulanci (n = 303), kteří splňují kritéria DSM-IV pro schizofrenii, kteří zůstali stabilní po 12 týdnech otevřená léčba flexibilními dávkami FANAPT (8 mg / den - 24 mg / den podávanými jako dávky dvakrát denně) byla randomizována do placeba nebo pokračovala v jejich současná dávka FANAPT (8 mg / den - 24 mg / den podávaná jako dávky dvakrát denně) pro sledování možného relapsu během dvojitě slepého relapsu fáze prevence. Stabilizace během otevřené fáze byla definována jako stanovení stanovené dávky FANAPT, která se nezměnila kvůli účinnosti během 4 týdnů před randomizací, mající skóre závažnosti CGI ≤ 4 a celkové skóre PANSS ≤ 70, skóre ≤ 4 pro každou z následujících jednotlivých položek PANSS (bludy, P2-konceptuální dezorganizace, P3-halucinatorní chování, podezření / perzekuce P6, nepřátelství P7 nebo nespolupráce G8) a žádná hospitalizace ani zvýšení úrovně péče při léčbě exacerbace. Relaps nebo blížící se relaps během fáze prevence relapsu dvojitě zaslepeným byl definován jako kterýkoli z následující: hospitalizace kvůli zhoršení schizofrenie, zvýšení (zhoršení) celkového skóre PANSS ≥ 30%, CGI-
Skóre zlepšení ≥ 6, pacient měl sebevražedné, vražedné nebo agresivní chování nebo potřeboval jiné antipsychotické léky.

Na základě prozatímní analýzy nezávislý výbor pro monitorování údajů rozhodl, že by studie měla být z důvodu důkazu o účinnosti přerušena. Na základě výsledků průběžné analýzy, které byly potvrzeny souborem konečné analýzy, byli pacienti léčeni FANAPT zaznamenal statisticky významný delší čas na relaps nebo nastupující relapsu než pacienti, kteří dostávali placebo. Obrázek 1 zobrazuje odhadovaný kumulativní podíl pacientů s relapsem nebo blížícím se relapsem na základě konečného souboru údajů.
horní
Jak dodáván / skladování a manipulace
Tablety FANAPT jsou bílé, kulaté a označené logem vyraženým na jedné straně a silou tablety „1“, „2“, „4“, „6“, „8“, „10“ nebo „12“ na druhé straně postranní. Tablety jsou dodávány v následujících silných a konfiguracích balíčků:

Úložný prostor
Tablety FANAPT skladujte při kontrolované pokojové teplotě, 25 ° C (77 ° F); dovolené odchylky od 15 ° do 30 ° C (viz teplota regulovaná USP). Chraňte tablety FANAPT před vystavením světlu a vlhkosti.
INFORMACE O PORADENSTVÍ PACIENTA
Lékařům se doporučuje diskutovat o těchto problémech s pacienty, kterým předepisují FANAPT:
Prodloužení intervalu QT
Pacientům by mělo být doporučeno, aby se okamžitě poradili se svým lékařem, pokud se cítí slabí, ztrácí vědomí nebo mají bušení srdce. Pacienti by měli být poučeni, aby neužívali FANAPT s jinými léky, které způsobují prodloužení QT intervalu. Pacientům by mělo být sděleno, aby informovali lékaře, že užívají FANAPT, než začnou užívat jakýkoli nový lék.
Neuroleptický maligní syndrom
Pacienti a pečovatelé by měli být poučeni, že se někdy odkazuje na potenciálně fatální symptomový komplex jako NMS byla hlášena v souvislosti s podáváním antipsychotik včetně FANAPT. Mezi příznaky a příznaky NMS patří hyperpyrexie, svalová rigidita, změněný duševní stav a důkaz autonomie
nestabilita (nepravidelný puls nebo krevní tlak, tachykardie, diaforéza a srdeční dysrytmie).
Metabolické změny
Pacienti by si měli být vědomi příznaků hyperglykémie (vysoká hladina cukru v krvi) a diabetes mellitus. Pacienti s diagnózou diabetu, pacienti s rizikovými faktory diabetu nebo ti, kteří je vyvinou příznaky během léčby by měla být hladina glukózy v krvi monitorována na začátku a pravidelně během léčba. Pacienti by měli být upozorněni, že během léčby přípravkem FANAPT došlo k nárůstu hmotnosti. Doporučuje se klinické sledování hmotnosti.
Ortostatická hypotenze
Pacienti by měli být poučeni o riziku ortostatické hypotenze, zejména v době zahájení léčby, opětovného zahájení léčby nebo zvýšení dávky.
Rušení kognitivního a motorického výkonu
Protože FANAPT může mít potenciál narušit úsudek, myšlení nebo motorické dovednosti, měli by být pacienti opatrní obsluha nebezpečných strojů, včetně automobilů, dokud si nejsou zcela jisti, že terapie FANAPT na ně nemá vliv nepříznivě.
Těhotenství
Upozorněte pacienty, že užívání přípravku Fanapt ve třetím trimestru může u novorozence vyvolat extrapyramidové a / nebo abstinenční příznaky. Doporučit pacientům, aby informovali svého poskytovatele zdravotní péče o známém nebo podezřelém těhotenství.
Registr těhotenství
Upozorněte pacientky, že existuje registr těhotenské expozice, který sleduje těhotenské výsledky u žen vystavených FANAPT během těhotenství
Laktace
Během léčby přípravkem FANAPT nedoporučujte ženám kojit.
Souběžné léky
Pacientům by mělo být doporučeno, aby informovali své lékaře, pokud užívají nebo plánují užívat jakýkoli lék na předpis nebo nadměrný počet léků, protože existuje možnost interakce.
Alkohol
Pacienti by měli být upozorněni, aby se během užívání přípravku FANAPT vyhýbali alkoholu.
Tepelná expozice a dehydratace
Pacienti by měli být poučeni o vhodné péči, aby nedošlo k přehřátí a dehydrataci.
Distribuovány:
Vanda Pharmaceuticals Inc.
Washington, D.C. 20037 USA
Vanda a Fanapt® jsou registrované ochranné známky společnosti Vanda Pharmaceuticals Inc. ve Spojených státech a dalších zemích.
zpět na začátek
Fanapt (Iloperidone) Příručka pro předepisování (PDF)
Účelem informací v této monografii není pokrýt všechna možná použití, pokyny, preventivní opatření, lékové interakce nebo nepříznivé účinky. Tyto informace jsou zobecněné a neslouží jako zvláštní lékařská pomoc. Máte-li dotazy týkající se léků, které užíváte, nebo byste chtěli získat více informací, obraťte se na svého lékaře, lékárníka nebo zdravotní sestru.
poslední aktualizace 07/13
zpět k: Farmakologie psychiatrických léků Domovská stránka


