Glukofág pro léčbu cukrovky
Název značky: Glucophage
Obecný název: metformin hydrochloride
Dávková forma: tablety s prodlouženým uvolňováním
Obsah:
Popis
Klinická farmakologie
Indikace a použití
Kontraindikace
Varování
Opatření
Lékové interakce
Nežádoucí reakce
Předávkovat
Dávkování
Dodáván
Glucohage, metformin hydrochloride, informace o pacientech (v prosté angličtině)
Popis
Tablety Glucophage® (metformin hydrochloride) a Glucophage® XR (metformin hydrochloride) Tablety s prodlouženým uvolňováním jsou perorální antihyperglykemická léčiva používaná při léčbě diabetu 2. typu. Hydrochlorid metforminu (hydrochlorid N, N-dimethylimidodikarbonimidového diamidu) není chemicky ani farmakologicky příbuzný žádné jiné třídě perorálních antihyperglykemických látek. Strukturální vzorec je znázorněn:
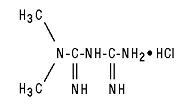
Hydrochlorid metforminu je bílá až téměř bílá krystalická sloučenina s molekulovým vzorcem C4H11N5-HCI a molekulovou hmotností 165,63. Hydrochlorid metforminu je volně rozpustný ve vodě a je prakticky nerozpustný v acetonu, etheru a chloroformu. PKa metforminu je 12,4. Hodnota pH 1% vodného roztoku metformin-hydrochloridu je 6,68.
Glukofágové tablety obsahují 500 mg, 850 mg nebo 1000 mg hydrochloridu metforminu. Každá tableta obsahuje neaktivní složky povidon a stearát hořečnatý. Povlak pro tablety 500 mg a 850 mg navíc obsahuje hypromelózu a povlak pro tabletu 1000 mg obsahuje hypromelózu a polyethylenglykol.
Glucophage XR obsahuje 500 mg nebo 750 mg hydrochloridu metforminu jako aktivní složku.
Tablety Glucophage XR 500 mg obsahují neaktivní složky sodné soli karboxymethylcelulózy, hypromelózy, mikrokrystalické celulózy a stearátu hořečnatého.
Tablety Glucophage XR 750 mg obsahují neaktivní složky sodné soli karboxymethylcelulózy, hypromelózy a stearátu hořečnatého.
Složky systému a Performance-Glucophage XR obsahuje duální hydrofilní polymerní matricový systém. Hydrochlorid metforminu je kombinován s polymerem regulujícím uvolňování léčiva za vzniku "vnitřní" fáze, která je pak začleněna jako diskrétní částice do "externí" fáze druhého polymeru. Po podání tekutina z gastrointestinálního (GI) traktu vstupuje do tablety, což způsobuje hydrataci a nabobtnání polymerů. Lék se uvolňuje pomalu z lékové formy difúzí gelovou matricí, která je v podstatě nezávislá na pH. Hydratovaný polymerní systém není rigidní a očekává se, že se rozpadne normální peristaltikou v gastrointestinálním traktu. Biologicky inertní složky tablety mohou občas zůstat během GI tranzitu a budou vyloučeny ve stolici jako měkká hydratovaná hmota.
horní
Klinická farmakologie
Mechanismus účinku
Metformin je antihyperglykemické činidlo, které zlepšuje toleranci glukózy u pacientů s diabetem typu 2 a snižuje jak bazální, tak postprandiální plazmatickou glukózu. Jeho farmakologické mechanismy účinku se liší od jiných tříd orálních antihyperglykemických látek. Metformin snižuje produkci glukózy v játrech, snižuje absorpci glukózy ve střevě a zlepšuje citlivost na inzulín zvýšením absorpce a využití periferní glukózy. Na rozdíl od sulfonylmočovin metformin nevyvolává hypoglykémii ani u pacientů s diabetem typu 2 ani u normálních osob (s výjimkou zvláštních okolností viz OPATŘENÍ) a nezpůsobuje hyperinzulinémii. Při léčbě metforminem zůstává sekrece inzulínu nezměněna, zatímco hladiny inzulínu nalačno nalačno a celodenní plazmatická odpověď na inzulín se mohou ve skutečnosti snížit.
Farmakokinetika
Absorpce a biologická dostupnost
Absolutní biologická dostupnost 500 mg tablety Glucophage podávané nalačno je přibližně 50% až 60%. Studie používající jednotlivé orální dávky Glucophage 500 až 1500 mg a 850 až 2550 mg naznačují, že je nedostatek úměrnost dávky se zvyšujícími se dávkami, která je způsobena spíše sníženou absorpcí než změnou v odstranění. Jídlo snižuje rozsah a mírně oddaluje absorpci metforminu, jak ukazuje přibližně o 40% nižší průměrná maximální plazma koncentrace (Cmax), o 25% nižší plocha pod křivkou koncentrace v plazmě versus čas (AUC) a prodloužení času do dosažení 35 minut plazmatická koncentrace (Tmax) po podání jedné 850 mg tablety metforminu s jídlem, ve srovnání se stejnou silou tablety podávané půst. Klinický význam těchto poklesů není znám.
Po jednorázové perorální dávce Glucophage XR je Cmax dosaženo se střední hodnotou 7 hodin a rozsahem 4 až 8 hodin. Maximální plazmatické hladiny jsou přibližně o 20% nižší ve srovnání se stejnou dávkou Glucophage, rozsah absorpce (měřeno pomocí AUC) je však podobný jako u Glucophage.
V ustáleném stavu jsou AUC a Cmax pro Glucophage XR méně než úměrné dávce v rozmezí 500 až 2000 mg podávané jednou denně. Maximální plazmatické hladiny jsou přibližně 0,6, 1,1, 1,4 a 1,8 µg / ml pro dávky 500, 1000, 1500 a 2000 mg jednou denně. Rozsah absorpce metforminu (měřeno pomocí AUC) z Glucophage XR v dávce 2000 mg jednou denně je podobný stejné celkové denní dávce podávané jako tablety Glucophage 1000 mg dvakrát denně. Po opakovaném podání Glucophage XR se metformin nehromadil v plazmě.
Variabilita Cmax a AUC metforminu z Glucophage XR v rámci subjektu je srovnatelná s variabilitou u Glucophage.
Ačkoli míra absorpce metforminu (měřeno pomocí AUC) z tablety Glucophage XR vzrostlo přibližně o 50%, když se podávalo s jídlem, neměl žádný účinek na Cmax a Tmax metformin. Strava s vysokým i nízkým obsahem tuku měla stejný účinek na farmakokinetiku Glucophage XR.
Rozdělení
Zdánlivý distribuční objem (V / F) metforminu po jedné orální dávce 850 mg Glucophage byl průměrně 654 ± 358 L. Metformin se zanedbatelně váže na plazmatické proteiny, na rozdíl od sulfonylmočovin, na které se váže více než 90% proteinů. Metforminové dělení na erytrocyty, s největší pravděpodobností jako funkce času. Při obvyklých klinických dávkách a dávkovacích schématech Glukofágu je plazmatických koncentrací metforminu v rovnovážném stavu dosaženo během 24 až 48 hodin a obvykle
Metabolismus a eliminace
Intravenózní studie s jednou dávkou u normálních jedinců ukazují, že metformin je vylučován v nezměněné podobě moč a nepodléhá jaternímu metabolismu (u lidí nebyly identifikovány žádné metabolity) ani biliární vylučování. Renální clearance (viz stůl 1) je přibližně 3,5krát větší než clearance kreatininu, což ukazuje, že tubulární sekrece je hlavní cestou eliminace metforminu. Po perorálním podání je přibližně 90% absorbovaného léčiva eliminováno renální cestou během prvních 24 hodin, s plazmatickým eliminačním poločasem přibližně 6,2 hodin. V krvi je eliminační poločas přibližně 17,6 hodin, což naznačuje, že masa erytrocytů může být distribučním oddílem.
Zvláštní populace
Pacienti s diabetem 2. typu
V přítomnosti normální funkce ledvin neexistují žádné rozdíly mezi farmakokinetikou metforminu pro jednu nebo více dávek mezi pacienty s diabetem 2. typu a normálními jedinci (viz stůl 1), ani v žádné skupině nedochází k hromadění metforminu v obvyklých klinických dávkách.
Farmakokinetika Glucophage XR u pacientů s diabetem 2. typu je srovnatelná s farmakokinetikou zdravých normálních dospělých.
Renální nedostatečnost
U pacientů se sníženou funkcí ledvin (na základě změřené clearance kreatininu) je plazmatický poločas a krevní poločas metformin je prodloužen a renální clearance je snížena úměrně ke snížení clearance kreatininu (viz stůl 1; také vidět VAROVÁNÍ).
Jaterní nedostatečnost
U pacientů s jaterní nedostatečností nebyly provedeny žádné farmakokinetické studie metforminu.
Geriatrie
Omezená data z kontrolovaných farmakokinetických studií Glukofágu u zdravých starších jedinců naznačují, že celková plazma clearance metforminu je snížena, poločas je prodloužen a Cmax je zvýšena ve srovnání se zdravými mláďaty předmětů. Z těchto údajů se zdá, že změna farmakokinetiky metforminu se stárnutím je primárně způsobena změnou renálních funkcí (viz viz stůl 1). Tablety Glucophage (metformin hydrochloride) a Glucophage XR (metformin hydrochloride) Léčba tabletami s prodlouženým uvolňováním by neměla být zahájen u pacientů ve věku 80 let, pokud měření clearance kreatininu neprokáže, že funkce ledvin není snížena (vidět VAROVÁNÍ a DÁVKOVÁNÍ A PODÁNÍ).
Tabulka 1: Vyberte průměrné (± S.D.) Farmakokinetické parametry metforminu po jedné nebo více orálních dávkách glukofágu
| Skupiny pacientů: Glukofágová dávkaA (počet předmětů) |
Cmaxb (µg / mL) |
TmaxC (hod.) |
Renální vůle (ml / min) |
|---|---|---|---|
| A Všechny dávky byly podány nalačno, kromě prvních 18 dávek studií s více dávkami | |||
| b Maximální koncentrace v plazmě | |||
| C Čas do dosažení maximální plazmatické koncentrace | |||
| d Kombinované výsledky (průměrný průměr) pěti studií: průměrný věk 32 let (rozmezí 23–59 let) | |||
| E Kinetická studie provedená po dávce 19, nalačno | |||
| F Starší lidé, průměrný věk 71 let (rozmezí 65–81 let) | |||
| G CLcr = clearance kreatininu normalizovaná na povrch těla 1,73 m2 | |||
| Zdraví, nediabetičtí dospělí: | |||
| 500 mg jednorázová dávka (24) | 1.03 ( ±0.33) | 2.75 ( ±0.81) | 600 ( ±132) |
| 850 mg jednotlivá dávka (74)d | 1.60 ( ±0.38) | 2.64 ( ±0.82) | 552 ( ±139) |
| 850 mg třikrát denně pro 19 dávekE (9) | 2.01 ( ±0.42) | 1.79 ( ±0.94) | 642 ( ±173) |
| Dospělí s diabetem 2. typu: | |||
| 850 mg jednorázová dávka (23) | 1.48 ( ±0.5) | 3.32 ( ±1.08) | 491 ( ±138) |
| 850 mg třikrát denně pro 19 dávekE (9) | 1.90 ( ±0.62) | 2.01 ( ±1.22) | 550 ( ±160) |
| Staršíf, zdraví nediabetičtí dospělí: | |||
| 850 mg jednorázová dávka (12) | 2.45 ( ±0.70) | 2.71 ( ±1.05) | 412 ( ±98) |
| Dospělí postižení dospělí: | |||
| 850 mg jednotlivá dávka | |||
| Mírný (CLcrG 61-90 ml / min) (5) | 1.86 ( ±0.52) | 3.20 ( ±0.45) | 384 ( ±122) |
| Mírný (CLcr 31-60 ml / min) (4) | 4.12 ( ±1.83) | 3.75 ( ±0.50) | 108 ( ±57) |
| Těžké (CLcr 10-30 ml / min) (6) | 3.93 ( ±0.92) | 4.01 ( ±1.10) | 130 ( ±90 |
Pediatrie
Po podání jedné perorální tablety Glucophage 500 mg s jídlem se geometrická průměrná Cmax a AUC metforminu lišila mezi méně než 5% pediatričtí pacienti s diabetem 2. typu (ve věku 12-16 let) a zdraví dospělí s věkem a váhou (20-45 let), všichni s normálními ledvinami funkce
Rod
Farmakokinetické parametry metforminu se mezi normálními pacienty a pacienty s diabetem typu 2 významně nelišily, pokud byly analyzovány podle pohlaví (muži = 19, ženy = 16). Podobně v kontrolovaných klinických studiích u pacientů s diabetem 2. typu byl antihyperglykemický účinek Glukofágu srovnatelný u mužů a žen.
Závod
Nebyly provedeny žádné studie farmakokinetických parametrů metforminu podle rasy. V kontrolovaných klinických studiích s glukofágem u pacientů s diabetem 2. typu byl antihyperglykemický účinek srovnatelný u bílých (n = 249), černých (n = 51) a hispánských (n = 24).
Klinické studie
Glukofág
V dvojitě zaslepené, placebem kontrolované, multicentrické klinické studii v USA zahrnující obézní pacienty s diabetem 2. typu, jejichž hyperglykémie nebyla dostatečně kontrolována samotný dietní management (základní hladina glukózy v plazmě nalačno [FPG] přibližně 240 mg / dl), léčba glukofágem (až 2550 mg / den) po dobu 29 týdnů vedla k významnému průměrné čisté snížení plazmatické glukózy nalačno a postprandiální plazmatické glukózy (PPG) a hemoglobinu A1c (HbA1c) o 59 mg / dl, 83 mg / dl a 1,8%, ve srovnání s placebovou skupinou (viz Tabulka 2).
Tabulka 2: Souhrn průměrných změn glukózy a placeba oproti výchozím hodnotám * v plazmatické glukóze nalačno, HbA1ca tělesná hmotnost při závěrečné návštěvě (29týdenní studie)
| Glukofág (n = 141) |
Placebo (n = 145) |
p-hodnota | |
|---|---|---|---|
| * Všichni pacienti, kteří užívají dietu v Baseline | ** Není statisticky významné | ||
| FPG (mg / dl) Základní hodnota Změna na ZÁVĚREČNÉ NÁVŠTĚVĚ |
241.5 -53.0 |
237.7 6.3 |
NS ** 0.001 |
| Hemoglobin A1c (%) Základní hodnota Změna na ZÁVĚREČNÉ NÁVŠTĚVĚ |
8.4 -1.4 |
8.2 0.4 |
NS ** 0.001 |
| Tělesná hmotnost (kg) Základní hodnota Změna na ZÁVĚREČNÉ NÁVŠTĚVĚ |
201.0 -1.4 |
206.0 -2.4 |
NS ** NS ** |
U obézních pacientů s typem 2 byla provedena 29-týdenní, dvojitě zaslepená, placebem kontrolovaná studie Glukofágu a glyburidu, samostatně a v kombinaci. diabetes, který nedosáhl dostatečné kontroly glykémie při maximálních dávkách glyburidu (výchozí FPG přibližně 250 mg / dl) (viz tabulka 3). Pacienti randomizovaní do kombinovaného ramene zahájili terapii Glucophage 500 mg a glyburidem 20 mg. Na konci každého týdne prvních 4 týdnů studie měli tito pacienti zvýšené dávky glukofágu o 500 mg, pokud nedosáhli cílové plazmatické glukózy nalačno. Po 4. týdnu byly takové úpravy dávky prováděny měsíčně, ačkoli žádný pacient neměl povoleno překročit Glucophage 2500 mg. Pacienti v rameni pouze s glukofágem (metformin plus placebo) postupovali podle stejného titračního plánu. Na konci studie přibližně 70% pacientů v kombinované skupině užívalo Glucophage 2000 mg / glyburid 20 mg nebo Glucophage 2500 mg / glyburid 20 mg. U pacientů randomizovaných pro pokračování v glyburidu došlo ke zhoršení glykemické kontroly se středním zvýšením FPG, PPG a HbA1c o 14 mg / dl, 3 mg / dl a 0,2%. Naproti tomu u randomizovaných pacientů s glukofágem (až 2 500 mg / den) došlo k mírnému zlepšení s průměrným snížením FPG, PPG a HbA1c o 1 mg / dl, 6 mg / dl a 0,4%. Kombinace glukofágu a glyburidu byla účinná při snižování hladin FPG, PPG a HbA1c o 63 mg / dl, 65 mg / dl a 1,7%. Ve srovnání s výsledky léčby samotným glyburidem byly čisté rozdíly v kombinaci s léčbou kombinací -77 mg / dl, -68 mg / dl a -1,9% (viz tabulka 3).
Tabulka 3: Kombinovaná monoterapie glukofágem / glyburidem (hřebenem) vs. glykémidem (glykof) nebo glukofágem (GLU): shrnutí průměrných změn oproti základní hladině * v plazmatické glukóze nalačno, HbA1ca tělesná hmotnost při závěrečné návštěvě (29týdenní studie)
| p-hodnoty | ||||||
|---|---|---|---|---|---|---|
| Hřeben (n = 213) |
Glyb (n = 209) |
GLU (n = 210) |
Glyb vs Hřeben |
GLU vs Hřeben |
GLU vs Glyb |
|
| * Všichni pacienti užívající glyburid, 20 mg / den, na začátku studie | ** Není statisticky významné | |||||
| Plazmatická glukóza nalačno (mg / dl) | ||||||
| Základní hodnota Změna na ZÁVĚREČNÉ NÁVŠTĚVĚ |
250.5 -63.5 |
247.5 13.7 |
253.9 -0.9 |
NS ** 0.001 |
NS ** 0.001 |
NS ** 0.025 |
| Hemoglobin A1c (%) | ||||||
| Základní hodnota Změna na ZÁVĚREČNÉ NÁVŠTĚVĚ |
8.8 -1.7 |
8.5 0.2 |
8.9 -0.4 |
NS ** 0.001 |
NS ** 0.001 |
0.007 0.001 |
| Tělesná hmotnost (kg) | ||||||
| Základní hodnota Změna na ZÁVĚREČNÉ NÁVŠTĚVĚ |
202.2 0.9 |
203.0 -0.7 |
204.0 -8.4 |
NS ** 0.011 |
NS ** 0.001 |
NS ** 0.001 |
Rozsah poklesu koncentrace glukózy v krvi nalačno po zavedení Terapie glukofágem (metformin hydrochlorid) byla úměrná hladině nalačno hyperglykémie. U pacientů s diabetem 2. typu s vyššími koncentracemi glukózy nalačno došlo k většímu poklesu glukózy v plazmě a glykosylovaného hemoglobinu.
V klinických studiích snížil Glucophage samostatně nebo v kombinaci se sulfonylmočovinou průměrné sérum nalačno hladiny triglyceridů, celkového cholesterolu a LDL cholesterolu a neměly nepříznivé účinky na jiné hladiny lipidů (viz Tabulka 4).
Tabulka 4: Shrnutí průměrné procentuální změny oproti výchozím hodnotám hlavních sérových lipidových proměnných při závěrečné návštěvě (29týdenní studie)
| Glucophage vs Placebo | Kombinovaný glukofág / glyburid vs Monoterapie |
||||
|---|---|---|---|---|---|
| Glukofág (n = 141) |
Placebo (n = 145) |
Glukofág (n = 210) |
Glukofág / Glyburid (n = 213) |
Glyburid (n = 209) |
|
| Celkový cholesterol (mg / dl) | |||||
| Základní hodnota Průměrné% změny při závěrečné návštěvě |
211.0 -5% |
212.3 1% |
213.1 -2% |
215.6 -4% |
219.6 1% |
| Celkové triglyceridy (mg / dl) | |||||
| Základní hodnota Průměrné% změny při závěrečné návštěvě |
236.1 -16% |
203.5 1% |
242.5 -3% |
215.0 -8% |
266.1 4% |
| LDL-cholesterol (mg / dl) | |||||
| Základní hodnota Průměrné% změny při závěrečné návštěvě |
135.4 -8% |
138.5 1% |
134.3 -4% |
136.0 -6% |
137.5 3% |
| HDL-cholesterol (mg / dl) | |||||
| Základní hodnota Průměrné% změny při závěrečné návštěvě |
39.0 2% |
40.5 -1% |
37.2 5% |
39.0 3% |
37.0 1% |
Na rozdíl od sulfonylmočovin měla tělesná hmotnost jednotlivců na glukofágu tendenci zůstat stabilní nebo dokonce mírně klesat (viz viz Tabulky 2 a 3).
Byla provedena 24týdenní, dvojitě zaslepená, placebem kontrolovaná studie Glucophage plus inzulín versus inzulín plus placebo provedeno u pacientů s diabetem 2. typu, u nichž se nedosáhlo dostatečné kontroly glykémie u samotného inzulínu (viz Tabulka 5). Pacienti randomizovaní k podávání Glucophage plus inzulinu dosáhli snížení HbA1c o 2,10%, ve srovnání s 1,56% snížením HbA1c dosaženým inzulínem plus placebem. Zlepšení glykemické kontroly bylo dosaženo při závěrečné studijní návštěvě s 16% méně inzulínu, 93,0 U / den vs. 110,6 U / den, Glucophage plus inzulín versus inzulín plus placebo, p = 0,04.
Tabulka 5: Souhrn průměrných změn oproti výchozím hodnotám v HbA kombinovaného glukofága / inzulínu vs. placeba / insulinu1c a denní dávka inzulínu
| Glukofág / Inzulín (n = 26) |
Placebo/ Inzulín (n = 28) |
Léčba Rozdíl Průměr ± SE |
|
|---|---|---|---|
|
A Statisticky významné pomocí analýzy kovariance s výchozím stavem jako kovariát (p = 0,04) Ne významné pomocí analýzy rozptylu (hodnoty jsou uvedeny v tabulce) | |||
| b Statisticky významné pro inzulín (p = 0,04) | |||
| Hemoglobin A1c (%) | |||
| Základní hodnota Změna na ZÁVĚREČNÉ NÁVŠTĚVĚ |
8.95 -2.10 |
9.32 -1.56 |
-0.54 ± 0.43A |
| Inzulinová dávka (U / den) | |||
| Základní hodnota Změna na ZÁVĚREČNÉ NÁVŠTĚVĚ |
93.12 -0.15 |
94.64 15.93 |
-16.08 ± 7.77b |
Druhá dvojitě zaslepená, placebem kontrolovaná studie (n = 51) se 16 týdny randomizované léčby prokázala, že u pacientů s diabetem 2. typu kontrolovaných na inzulínu po dobu 8 týdnů s průměrným HbA1c 7,46 ± 0,97% si přidávání Glucophage udržovalo podobnou kontrolu glykémie (HbA1c 7,15 ± 0,61 vs 6,97 ± 0,62 pro Glucophage plus inzulín a placebo plus inzulín) s 19% méně inzulínu oproti základní linii (snížení o 23,68 ± 30,22 vs zvýšení o 0,43 ± 25,20 jednotek pro Glucophage plus inzulín a placebo plus inzulín, p <0,01). Tato studie navíc prokázala, že kombinace Glucophage plus inzulín vedla ke snížení v tělesné hmotnosti 3,11 ± 4,30 liber, ve srovnání se zvýšením o 1,30 ± 6,08 liber u placeba plus inzulínu, p = 0,01.
Glucophage XR
24týdenní, dvojitě zaslepená, placebem kontrolovaná studie Glucophage XR, užívaná jednou denně s večerním jídlem, byla provedena pacienti s diabetem 2. typu, u nichž se nedosáhlo kontroly glykémie dietou a cvičením (HbA1c 7,0% -10,0%, FPG 126-270 mg / dl). Pacienti vstupující do studie měli průměrnou výchozí hladinu HbA1c 8,0% a průměrnou základní hladinu FPG 176 mg / dl. Po 12 týdnech léčby se průměrný HbA1c zvýšil ze základní hodnoty o 0,1% a průměrný FPG se snížil ze základní hodnoty o 2 mg / dl ve skupině s placebem, ve srovnání se snížením průměrného HbA1c o 0,6% a se snížením průměrného FPG o 23 mg / dl u pacientů léčených Glucophage XR 1000 mg jednou denně. Následně byla léčebná dávka zvýšena na 1500 mg jednou denně, pokud byl HbA1c ¥ 7,0%, ale <8,0% (pacienti ze studie byli léčeni HbA1c ¥ ¥ 8,0%). Při poslední návštěvě (24 týdnů) se průměrný HbA1c zvýšil u pacientů s placebem o 0,2% oproti výchozímu stavu a u Glucophage XR se snížil o 0,6%.
16týdenní, dvojitě zaslepená, placebem kontrolovaná studie Glucophage XR, závislá na dávce, užívaná jednou denně s večerním jídlem nebo dvakrát denně s jídlem, byl proveden u pacientů s diabetem 2. typu, u nichž se nedosáhlo kontroly glykémie dietou a cvičením (HbA1c 7,0% -11,0%, FPG 126-280 mg / dl). Změny v glykemické kontrole a tělesné hmotnosti jsou uvedeny v tabulce 6.
Tabulka 6: Shrnutí průměrných změn oproti výchozímu stavu * v HbA1c, Plazmatická glukóza nalačno a tělesná hmotnost při závěrečné návštěvě (16týdenní studie)
| Glucophage XR | Placebo | |||||
|---|---|---|---|---|---|---|
| 500 mg Jednou Denně |
1000 mg Jednou Denně |
1500 mg Jednou Denně |
2000 mg Jednou Denně |
1000 mg Dvakrát Denně |
||
| * Všichni pacienti, kteří užívají dietu v Baseline | ||||||
| A Všechna srovnání versus Placebo | ||||||
| ** Není statisticky významné | ||||||
| Hemoglobin A1c (%) | (n = 115) | (n = 115) | (n = 111) | (n = 125) | (n = 112) | (n = 111) |
| Základní hodnota | 8.2 | 8.4 | 8.3 | 8.4 | 8.4 | 8.4 |
| Změna na ZÁVĚREČNÉ NÁVŠTĚVĚ | -0.4 | -0.6 | -0.9 | -0.8 | -1.1 | 0.1 |
| p-hodnotaA | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| FPG (mg / dl) | (n = 126) | (n = 118) | (n = 120) | (n = 132) | (n = 122) | (n = 113) |
| Základní hodnota | 182.7 | 183.7 | 178.9 | 181.0 | 181.6 | 179.6 |
| Změna na ZÁVĚREČNÉ NÁVŠTĚVĚ | -15.2 | -19.3 | -28.5 | -29.9 | -33.6 | 7.6 |
| p-hodnotaA | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| Tělesná hmotnost (kg) | (n = 125) | (n = 119) | (n = 117) | (n = 131) | (n = 119) | (n = 113) |
| Základní hodnota | 192.9 | 191.8 | 188.3 | 195.4 | 192.5 | 194.3 |
| Změna na ZÁVĚREČNÉ NÁVŠTĚVĚ | -1.3 | -1.3 | -0.7 | -1.5 | -2.2 | -1.8 |
| p-hodnotaA | NS ** | NS ** | NS ** | NS ** | NS ** | - |
Ve srovnání s placebem bylo zlepšení glykemické kontroly pozorováno při všech hladinách dávky Glucophage XR (metformin) hydrochlorid) Tablety s prodlouženým uvolňováním a léčba nebyla spojena s významnou změnou hmotnosti (vidět DÁVKOVÁNÍ A PODÁNÍ pro doporučení dávkování pro Glucophage a Glucophage XR).
24týdenní, dvojitě zaslepená, randomizovaná studie Glucophage XR, užívaná jednou denně s večerním jídlem, a Glucophage (metformin hydrochloride) Tablety, užívaná dvakrát denně (s snídaně a večerní jídlo), byla prováděna u pacientů s diabetem 2. typu, kteří byli léčeni Glucophage 500 mg dvakrát denně po dobu nejméně 8 týdnů před vstupem do studie. Dávka glukofága nebyla nutně titrována pro dosažení specifické úrovně glykemické kontroly před vstupem do studie. Pacienti se kvalifikovali do studie, pokud HbA1c byl was 8,5% a FPG byl ¤ ‰ 200 mg / dl. Změny v glykemické kontrole a tělesné hmotnosti jsou uvedeny v tabulce 7.
Tabulka 7: Shrnutí průměrných změn oproti výchozímu stavu * v HbA1c, Plazmatická glukóza nalačno a tělesná hmotnost ve 12. týdnu a při závěrečné návštěvě (24týdenní studie)
| Glukofág 500 mg Dvakrát denně |
Glucophage XR | ||
|---|---|---|---|
| 1000 mg Jednou denně |
1500 mg Jednou denně |
||
| * Všichni pacienti užívající Glucophage 500 mg dvakrát denně na začátku studie | |||
| A n = 68 | |||
| Hemoglobin A1c (%) | (n = 67) | (n = 72) | (n = 66) |
| Základní hodnota | 7.06 | 6.99 | 7.02 |
| Změna ve 12 týdnech | 0.14 | 0.23 | 0.04 |
| (95% CI) | (-0.03, 0.31) | (0.10, 0.36) | (-0.08, 0.15) |
| Změna na ZÁVĚREČNÉ NÁVŠTĚVĚ | 0.14A | 0.27 | 0.13 |
| (95% CI) | (-0.04, 0.31) | (0.11, 0.43) | (-0.02, 0.28) |
| FPG (mg / dl) | (n = 69) | (n = 72) | (n = 70) |
| Základní hodnota | 127.2 | 131.0 | 131.4 |
| Změna ve 12 týdnech | 12.9 | 9.5 | 3.7 |
| (95% CI) | (6.5, 19.4) | (4.4, 14.6) | (-0.4, 7.8) |
| Změna na ZÁVĚREČNÉ NÁVŠTĚVĚ | 14.0 | 11.5 | 7.6 |
| (95% CI) | (7.0, 21.0) | (4.4, 18.6) | (1.0, 14.2) |
| Tělesná hmotnost (kg) | (n = 71) | (n = 74) | (n = 71) |
| Základní hodnota | 210.3 | 202.8 | 192.7 |
| Změna ve 12 týdnech | 0.4 | 0.9 | 0.7 |
| (95% CI) | (-0.4, 1.5) | (0.0, 2.0) | (-0.4, 1.8) |
| Změna na ZÁVĚREČNÉ NÁVŠTĚVĚ | 0.9 | 1.1 | 0.9 |
| (95% CI) | (-0.4, 2.2) | (-0.2, 2.4) | (-0.4, 2.0) |
Po 12 týdnech léčby došlo ke zvýšení průměrné HbA1c ve všech skupinách; ve skupině s 1 000 mg Glucophage XR byl statisticky významný nárůst oproti výchozímu stavu o 0,23% (viz DÁVKOVÁNÍ A PODÁNÍ).
Změny lipidových parametrů v dříve popsané placebem kontrolované studii dávka-odpověď Glucophage XR jsou uvedeny v tabulce 8.
Tabulka 8: Shrnutí průměrných procentních změn oproti výchozím hodnotám * u hlavních proměnných lipidů při závěrečné návštěvě (16týdenní studie)
| Glucophage XR | Placebo | |||||
|---|---|---|---|---|---|---|
| 500 mg Jednou Denně |
1000 mg Jednou Denně |
1500 mg Jednou Denně |
2000 mg Jednou Denně |
1000 mg Dvakrát Denně |
||
| * Všichni pacienti, kteří užívají dietu v Baseline | ||||||
| Celkový cholesterol (mg / dl) | (n = 120) | (n = 113) | (n = 110) | (n = 126) | (n = 117) | (n = 110) |
| Základní hodnota | 210.3 | 218.1 | 214.6 | 204.4 | 208.2 | 208.6 |
| Průměrné% změny při závěrečné návštěvě | 1.0% | 1.7% | 0.7% | -1.6% | -2.6% | 2.6% |
| Celkové triglyceridy (mg / dl) | (n = 120) | (n = 113) | (n = 110) | (n = 126) | (n = 117) | (n = 110) |
| Základní hodnota | 220.2 | 211.9 | 198.0 | 194.2 | 179.0 | 211.7 |
| Průměrné% změny při závěrečné návštěvě | 14.5% | 9.4% | 15.1% | 14.9% | 9.4% | 10.9% |
| LDL-cholesterol (mg / dl) | (n = 119) | (n = 113) | (n = 109) | (n = 126) | (n = 117) | (n = 107) |
| Základní hodnota | 131.0 | 134.9 | 135.8 | 125.8 | 131.4 | 131.9 |
| Průměrné% změny při závěrečné návštěvě | -1.4% | -1.6% | -3.5% | -3.3% | -5.5% | 3.2% |
| HDL-cholesterol (mg / dl) | (n = 120) | (n = 108) | (n = 108) | (n = 125) | (n = 117) | (n = 108) |
| Základní hodnota | 40.8 | 41.6 | 40.6 | 40.2 | 42.4 | 39.4 |
| Průměrné% změny při závěrečné návštěvě | 6.2% | 8.6% | 5.5% | 6.1% | 7.1% | 5.8% |
Změny lipidových parametrů v dříve popsané studii Glucophage a Glucophage XR jsou uvedeny v tabulce 9.
Tabulka 9: Shrnutí průměrných procentních změn oproti výchozím hodnotám * u hlavních proměnných lipidů při závěrečné návštěvě (24týdenní studie)
| Glukofág | Glucophage XR | ||
|---|---|---|---|
| 500 mg Dvakrát denně |
1000 mg Jednou denně |
1500 mg Jednou denně |
|
| * Všichni pacienti užívající Glucophage 500 mg dvakrát denně na začátku studie | |||
| Celkový cholesterol (mg / dl) | (n = 68) | (n = 70) | (n = 66) |
| Základní hodnota | 199.0 | 201.9 | 201.6 |
| Průměrné% změny při závěrečné návštěvě | 0.1% | 1.3% | 0.1% |
| Celkové triglyceridy (mg / dl) | (n = 68) | (n = 70) | (n = 66) |
| Základní hodnota | 178.0 | 169.2 | 206.8 |
| Průměrné% změny při závěrečné návštěvě | 6.3% | 25.3% | 33.4% |
| LDL-cholesterol (mg / dl) | (n = 68) | (n = 70) | (n = 66) |
| Základní hodnota | 122.1 | 126.2 | 115.7 |
| Průměrné% změny při závěrečné návštěvě | −1.3% | −3.3% | −3.7% |
| HDL-cholesterol (mg / dl) | (n = 68) | (n = 70) | (n = 65) |
| Základní hodnota | 41.9 | 41.7 | 44.6 |
| Průměrné% změny při závěrečné návštěvě | 4.8% | 1.0% | -2.1% |
Pediatrické klinické studie
Ve dvojitě slepé placebem kontrolované studii u pediatrických pacientů ve věku 10 až 16 let s diabetem 2. typu (průměr FPG 182,2 mg / dl), léčba glukofágem (až do 2000) mg / den) po dobu až 16 týdnů (průměrné trvání léčby 11 týdnů) mělo za následek významné průměrné čisté snížení FPG o 64,3 mg / dl ve srovnání s placebem (viz tabulka 10).
Tabulka 10: Glukofág vs. Placebo (PediatricsA) Shrnutí průměrných změn oproti základní hladině * v plazmatické glukóze a tělesné hmotnosti při závěrečné návštěvě
| Glukofág | Placebo | p-hodnota | |
|---|---|---|---|
| A Pediatričtí pacienti průměrný věk 13,8 let (rozmezí 10–16 let) | |||
| * Všichni pacienti, kteří užívají dietu v Baseline | |||
| ** Není statisticky významné | |||
| FPG (mg / dl) | (n = 37) | (n = 36) | |
| Základní hodnota Změna na ZÁVĚREČNÉ NÁVŠTĚVĚ |
162.4 -42.9 |
192.3 21.4 |
<0.001 |
| Tělesná hmotnost (kg) | (n = 39) | (n = 38) | |
| Základní hodnota Změna na ZÁVĚREČNÉ NÁVŠTĚVĚ |
205.3 -3.3 |
189.0 -2.0 |
NS ** |
horní
Indikace a použití
Glukofág (metformin hydrochlorid) Tablety jsou indikovány jako doplněk stravy a cvičení ke zlepšení kontroly glykémie u dospělých a dětí s diabetes mellitus 2. typu.
Tablety Glucophage XR (metformin hydrochloride) s prodlouženým uvolňováním jsou indikovány jako doplněk stravy a cvičení ke zlepšení kontroly glykémie u dospělých s diabetes mellitus 2. typu.
horní
Kontraindikace
Glucophage a Glucophage XR jsou kontraindikovány u pacientů s:
Onemocnění ledvin nebo renální dysfunkce (např. Jak je naznačeno hladinami kreatininu v séru 1,5 mg / dl [muži], 1,4 mg / dl [ženy] nebo abnormálními clearance kreatininu), která může být také důsledkem stavů, jako je kardiovaskulární kolaps (šok), akutní infarkt myokardu a septikémie (vidět VAROVÁNÍ a OPATŘENÍ).
Známá přecitlivělost na metformin hydrochlorid.
Akutní nebo chronická metabolická acidóza, včetně diabetické ketoacidózy, s kómou nebo bez ní. Diabetická ketoacidóza by měla být léčena inzulinem.
U pacientů podstupujících radiologické studie zahrnující Glucophage a Glucophage XR by mělo být dočasně přerušeno intravaskulární podávání jodovaných kontrastních materiálů, protože použití těchto produktů může vést k akutní změně renální funkce. (Viz také OPATŘENÍ.)
horní
Varování
Laktátová acidóza:
Laktátová acidóza je vzácná, ale závažná metabolická komplikace, ke které může dojít v důsledku akumulace metforminu během léčby Glucophage nebo Glucophage XR; pokud k tomu dojde, je fatální přibližně v 50% případů. Laktátová acidóza může také nastat ve spojení s řadou patofyziologických stavů, včetně diabetes mellitus, a vždy, když existuje významná tkáňová hypoperfúze a hypoxémie. Laktátová acidóza je charakterizována zvýšenými hladinami laktátu v krvi (> 5 mmol / l), sníženým pH krve, poruchami elektrolytů se zvýšenou aniontovou mezerou a zvýšeným poměrem laktát / pyruvát. Pokud je metformin implikován jako příčina laktátové acidózy, jsou obecně zjištěny plazmatické hladiny metforminu> 5 µg / ml.
Hlášená incidence laktátové acidózy u pacientů, kteří dostávají hydrochlorid metforminu, je velmi nízká (přibližně 0,03 případů / 1 000 pacientských let, s přibližně 0,015 fatálních případů / 1 000) pacient-roky). Ve více než 20 000 pacientských letech expozice metforminu v klinických studiích nebyly hlášeny žádné případy laktátové acidózy. Hlášené případy se vyskytly primárně u diabetických pacientů s významnou renální nedostatečností, včetně intrinsického renálního selhání onemocnění a renální hypoperfúze, často v prostředí mnohočetných souběžných lékařských / chirurgických problémů a mnohočetných souběžných léky. Pacienti s městnavým srdečním selháním, kteří vyžadují farmakologickou léčbu, zejména pacienti s nestabilním nebo akutní městnavé srdeční selhání, u nichž existuje riziko hypoperfúze a hypoxémie, je vystaveno zvýšenému riziku laktátu acidóza. Riziko laktátové acidózy se zvyšuje se stupněm renální dysfunkce a věku pacienta. Riziko laktátové acidózy může být proto významně sníženo pravidelným sledováním renálních funkcí v roce 2006 pacienti užívající Glucophage nebo Glucophage XR a při použití minimální účinné dávky Glucophage nebo Glucophage XR. Zejména by léčba starších osob měla být doprovázena pečlivým sledováním renálních funkcí. Léčba glukofágem nebo Glucophage XR by neměla být zahájena u pacientů ve věku 80 let, pokud není změřeno kreatininu clearance ukazuje, že renální funkce není snížena, protože tito pacienti jsou náchylnější k vývoji laktátu acidóza. Kromě toho je třeba Glucophage a Glucophage XR neprodleně zadržet v přítomnosti jakéhokoli stavu spojeného s hypoxémií, dehydratací nebo sepse. Protože zhoršená funkce jater může významně omezit schopnost čistit laktát, glukofág a Glucophage XR by se obecně neměl vyhýbat pacientům s klinickým nebo laboratorním důkazem jater choroba. Pacienti by měli být při užívání varováni před nadměrným příjmem alkoholu, ať už akutním nebo chronickým Glucophage nebo Glucophage XR, protože alkohol zesiluje účinky hydrochloridu metforminu na laktát metabolismus. Kromě toho by měly být Glucophage a Glucophage XR dočasně přerušeny před jakoukoli intravaskulární radiokontrastní studií a před jakýmkoli chirurgickým zákrokem (viz také OPATŘENÍ).
Nástup laktátové acidózy je často jemný a doprovázen pouze nespecifickými příznaky, jako je malátnost, myalgie, respirační potíže, zvyšující somnolence a nespecifické břišní potíže. Mohou být spojeny s podchlazením, hypotenzí a rezistentními bradyarytmiemi s výraznější acidózou. Pacient a lékař pacienta si musí být vědomi možného významu takových příznaků a pacient by měl být poučen, aby okamžitě informoval lékaře, pokud k nim dojde (viz také OPATŘENÍ). Glucophage a Glucophage XR by měly být odebrány, dokud nebude situace vyjasněna. Užitečné mohou být elektrolyty v séru, ketony, glukóza v krvi, a pokud je to indikováno, pH v krvi, hladiny laktátu a dokonce i hladiny metforminu v krvi. Jakmile je pacient stabilizován na jakékoli dávce Glucophage nebo Glucophage XR, je nepravděpodobné, že by gastrointestinální příznaky, které jsou běžné při zahájení léčby, souvisely s léky. Pozdější výskyt gastrointestinálních příznaků může být způsoben laktátovou acidózou nebo jiným závažným onemocněním.
Hladiny laktátového plazmatického laktátu nalačno nad horní hranicí normálu, ale nižší než 5 mmol / l u pacientů užívajících Glucophage nebo Glucophage XR nemusí nutně znamenat hrozící laktátová acidóza a lze ji vysvětlit jinými mechanismy, jako je špatně kontrolovaná cukrovka nebo obezita, intenzivní fyzická aktivita nebo technické problémy ve vzorku zacházení. (Viz také OPATŘENÍ.)
U každého diabetického pacienta s podezřením na ketoacidózu (ketonurie a ketonémie) by mělo být podezření na laktátovou acidózu.
Laktátová acidóza je lékařská pohotovost, která musí být léčena v nemocničním zařízení. U pacientů s laktátovou acidózou, kteří užívají Glucophage nebo Glucophage XR, by léčivo mělo být okamžitě přerušeno a okamžitě by měla být zavedena obecná podpůrná opatření. Protože metformin hydrochlorid je dialyzovatelný (s clearance až 170 ml / min při dobré hemodynamice) podmínky), doporučuje se okamžitá hemodialýza pro korekci acidózy a odstranění nahromaděné metformin. Takové řízení často vede k okamžitému zvrácení symptomů a zotavení. (Viz také KONTRAINDIKACE a OPATŘENÍ.)
horní
Opatření
Všeobecné
Makrovaskulární výsledky - Nebyly provedeny žádné klinické studie prokazující přesvědčivé důkazy o snížení makrovaskulárního rizika u Glucophage nebo Glucophage XR nebo jakéhokoli jiného antidiabetika.
Sledování funkce ledvin - je známo, že metformin je vylučován v ledvinách a riziko hromadění metforminu a laktátové acidózy se zvyšuje se stupněm poškození ledvin funkce. Pacienti s hladinami kreatininu v séru nad horní hranicí normálu pro svůj věk by proto neměli dostávat Glucophage nebo Glucophage XR. U pacientů s pokročilým věkem by měly být Glucophage a Glucophage XR pečlivě titrovány minimální dávka pro odpovídající glykemický účinek, protože stárnutí je spojeno se sníženou funkcí ledvin funkce. U starších pacientů, zejména u pacientů ve věku 80 let, by měla být funkce ledvin pravidelně sledována a obecně by Glucophage a Glucophage XR neměly být titrovány na maximální dávku (viz. VAROVÁNÍ a DÁVKOVÁNÍ A PODÁNÍ).
Před zahájením léčby Glucophage nebo Glucophage XR a nejméně jednou ročně by měla být funkce ledvin vyhodnocena a ověřena jako normální. U pacientů, u nichž se očekává vývoj renální dysfunkce, by měla být vyhodnocena renální funkce častěji a Glucophage nebo Glucophage XR byly vysazeny, pokud je prokázána porucha ledvin současnost, dárek.
Užívání souběžných léků, které mohou ovlivnit funkci ledvin nebo dispozice metforminu - Souběžné léky, které mohou ovlivnit funkci ledvin nebo vést k významná hemodynamická změna nebo může interferovat s dispozicí metforminu, jako jsou kationtová léčiva, která jsou vylučována renální tubulární sekrecí (viz viz OPATŘENÍ: Lékové interakce), je třeba používat opatrně.
Radiologické studie zahrnující použití intravaskulárních jodovaných kontrastních materiálů (například intravenózního urogramu, intravenózně) cholangiografie, angiografie a počítačové tomografie (CT), skenování pomocí intravaskulárních kontrastních materiálů) - studie intravaskulárního kontrastu s Jodované materiály mohou vést k akutním změnám funkce ledvin a byly spojeny s laktátovou acidózou u pacientů, kteří dostávají metformin (viz KONTRAINDIKACE). U pacientů, u nichž je taková studie plánována, by proto mělo být Glucophage nebo Glucophage XR dočasně přerušeno v době nebo před zahájením léčby. po 48 hodinách od zákroku a obnoveno až po opětovném vyhodnocení renální funkce a zjištění, že normální.
Hypoxické stavy - kardiovaskulární kolaps (šok) z jakékoli příčiny, akutní městnavé srdeční selhání, akutní myokard infarkt a další stavy charakterizované hypoxémií byly spojeny s laktátovou acidózou a mohou také způsobit prerenální azotémie. Pokud k těmto událostem dojde u pacientů léčených glukofágem nebo Glucophage XR, mělo by být léčivo okamžitě přerušeno.
Chirurgické výkony - Glucophage nebo Glucophage XR by měla být dočasně pozastavena pro jakýkoli chirurgický zákrok (s výjimkou menších zákroků, které nejsou spojeny) s omezeným příjmem potravy a tekutin) a nemělo by se znovu zahájit, dokud se neobnoví perorální příjem pacienta a dokud se nevyhodnotí funkce ledvin jako normální.
Příjem alkoholu - Je známo, že alkohol zesiluje účinek metforminu na metabolismus laktátu. Pacienti by proto měli být během léčby Glucophage nebo Glucophage XR varováni před nadměrným příjmem alkoholu, akutním nebo chronickým.
Poškozená funkce jater - Protože zhoršená funkce jater byla spojena s některými případy laktátové acidózy, Glucophage a Glucophage XR by se obecně nemělo u pacientů s klinickým nebo laboratorním důkazem jater choroba.
Hladiny vitaminu B12 - v kontrolovaných klinických studiích s glukofágem trvajícím 29 týdnů, pokles na podnormální hladiny dříve normální hladiny vitaminu B12 v séru, bez klinických projevů, byly pozorovány přibližně u 7% pacientů. Takové snížení, pravděpodobně v důsledku interference s absorpcí B12 z komplexu faktorů vnitřní B12, je však velmi málokdy souvisí s anémií a zdá se, že je rychle reverzibilní po přerušení léčby glukofágem nebo vitamínem B12 doplnění. U pacientů užívajících Glucophage nebo Glucophage XR se doporučuje každoročně měřit hematologické parametry a veškeré zjevné abnormality by měly být náležitě vyšetřeny a léčeny (viz viz OPATŘENÍ: Laboratorní testy).
Někteří jedinci (ti s nedostatečným příjmem nebo absorpcí vápníku vitaminu B12 nebo s obsahem vápníku) se zdají být predisponováni k rozvoji subnormálních hladin vitaminu B12. U těchto pacientů může být užitečné rutinní měření sérového vitaminu B12 ve 2- až 3letých intervalech.
Změna klinického stavu pacientů s dříve kontrolovaným diabetem typu 2 - pacient s diabetem typu 2 dříve dobře kontrolovaným na Glucophage nebo Glucophage XR, který vyvine laboratorní abnormality nebo klinické onemocnění (zejména vágní a špatně definované onemocnění) by mělo být neprodleně vyhodnoceno z hlediska důkazů ketoacidózy nebo laktátu acidóza. Vyhodnocení by mělo zahrnovat sérové elektrolyty a ketony, glukózu v krvi a, pokud je to uvedeno, pH krve, hladiny laktátu, pyruvátu a metforminu. Pokud dojde k acidóze kterékoli formy, musí být Glucophage nebo Glucophage XR okamžitě zastaveno a musí být zahájena další vhodná nápravná opatření (viz také VAROVÁNÍ).
Hypoglykémie - K hypoglykémii nedochází u pacientů, kteří dostávají Glucophage nebo Glucophage XR samostatně za obvyklých okolností použití, ale může nastat, když je kalorický příjem nedostatečné, pokud namáhavé cvičení není kompenzováno kalorickou suplementací nebo při současném použití s jinými látkami snižujícími hladinu glukózy (jako jsou sulfonylmočoviny a inzulín) nebo ethanol.
Starší, oslabení nebo podvyživení pacienti a pacienti s adrenální nebo hypofyzární nedostatečností nebo intoxikací alkoholem jsou zvláště náchylní k hypoglykemickým účinkům. Hypoglykémie může být obtížné rozpoznat u starších osob au lidí, kteří užívají beta-adrenergní blokátory.
Ztráta kontroly nad hladinou glukózy v krvi - Když je pacient stabilizovaný na jakémkoli diabetickém režimu vystaven stresu, jako je horečka, trauma, infekce nebo chirurgický zákrok, může dojít k dočasné ztrátě glykemické kontroly. V takových případech může být nutné zadržet Glucophage nebo Glucophage XR a dočasně podat inzulín. Glukofág nebo Glucophage XR lze po vyřešení akutní epizody znovu obnovit.
Účinnost perorálních antidiabetik při snižování hladiny glukózy v krvi na cílovou hladinu u mnoha pacientů v průběhu času klesá. Tento jev, který může být způsoben progresí základního onemocnění nebo sníženou reakcí na lék, je známé jako sekundární selhání, aby se odlišilo od primárního selhání, při kterém je léčivo během počáteční terapie neúčinné. Pokud dojde k sekundárnímu selhání u Glucophage nebo Glucophage XR nebo u monoterapie sulfonylmočovinou, může kombinovaná terapie Glucophage nebo Glucophage XR a sulfonylmočovinou vést k odpovědi. Pokud dojde k sekundárnímu selhání při kombinované terapii Glucophage / sulfonylureou nebo Glucophage Při terapii XR / sulfonylmočovinou může být nutné zvážit terapeutické alternativy včetně zahájení léčby inzulinová terapie.
Informace pro pacienty
Pacienti by měli být informováni o možných rizicích a přínosech Glucophage nebo Glucophage XR ao alternativních způsobech léčby. Měli by být také informováni o důležitosti dodržování dietních pokynů a pravidelného cvičení program a pravidelné testování hladiny glukózy v krvi, glykosylovaného hemoglobinu, renálních funkcí a hematologic parametry.
Rizika laktátové acidózy, její příznaky a stavy, které předurčují její vývoj, jak je uvedeno v VAROVÁNÍ a OPATŘENÍ Sekce by měly být pacientům vysvětleny. Pacienti by měli být upozorněni, aby Glucophage nebo Glucophage XR okamžitě přerušili a neprodleně informovali o svém zdraví praktický lékař, pokud nevysvětlitelná hyperventilace, myalgie, malátnost, neobvyklá ospalost nebo jiné nespecifické příznaky nastat. Jakmile je pacient stabilizován na jakékoli dávce Glucophage nebo Glucophage XR, je nepravděpodobné, že by gastrointestinální příznaky, které jsou běžné při zahájení léčby metforminem, souvisely s léčivem. Pozdější výskyt gastrointestinálních příznaků může být způsoben laktátovou acidózou nebo jiným závažným onemocněním.
Během léčby Glucophage nebo Glucophage XR by pacienti měli být informováni o nadměrném příjmu alkoholu, ať už akutním nebo chronickém.
Glucophage nebo Glucophage XR samotný obvykle nezpůsobuje hypoglykémii, ačkoli se může vyskytnout, když se Glucophage nebo Glucophage XR používá ve spojení s perorálními sulfonylmočovinami a inzulínem. Při zahájení kombinované terapie rizika hypoglykémie, její příznaky a léčba a stavy, které mají predispozici k jejímu vývoji, by měly být vysvětleny pacientům a odpovědné rodině členy.
Pacienti by měli být informováni o tom, že Glucophage XR musí být spolknut celý a nesmí být rozdrcen nebo žvýkat, a že neaktivní přísady mohou být ve stolici vyloučeny jako měkká hmota, která se může podobat originálu tableta.
Laboratorní testy
Reakce na všechny diabetické terapie by měla být sledována periodickým měřením krevní hladiny nalačno hladiny glukózy a glykosylovaného hemoglobinu, s cílem snížit tyto hladiny směrem k normálu rozsah. Během počáteční titrace dávky lze ke stanovení terapeutické odpovědi použít glukózu nalačno. Poté by měla být monitorována jak glukóza, tak glykosylovaný hemoglobin. Měření glykosylovaného hemoglobinu může být zvláště užitečné pro vyhodnocení dlouhodobé kontroly (viz také DÁVKOVÁNÍ A PODÁNÍ).
Počáteční a periodické monitorování hematologických parametrů (např. Hemoglobinu / hematokritu a červené krve) indexy buněk) a funkce ledvin (sérový kreatinin) by měly být prováděny alespoň jednou ročně. Zatímco megaloblasticanémie byla při léčbě glukofágem zřídka pozorována, je-li to podezření, je třeba vyloučit nedostatek vitaminu B12.
Lékové interakce (klinické hodnocení lékových interakcí s glukofágem)
Glyburid - ve studii interakce s jednou dávkou u pacientů s diabetem 2. typu, společné podávání metformin a glyburid neměly žádné změny ve farmakokinetice metforminu ani farmakodynamika. Bylo pozorováno snížení AUC a Cmax glyburidu, ale byly velmi variabilní. Jednorázová povaha této studie a nedostatečná korelace mezi hladinami glyburidu v krvi a farmakodynamickými účinky způsobuje nejistotu klinického významu této interakce (viz viz DÁVKOVÁNÍ A PODÁNÍ: Souběžná terapie glukofágem nebo glukofágem XR a perorální terapie sulfonylureou u dospělých pacientů).
Furosemid - Jednorázová studie interakcí léčiv s metforminem a furosemidem u zdravých jedinců prokázala, že společné farmakokinetické parametry obou sloučenin byly ovlivněny. Furosemid zvýšil plazmatickou koncentraci metforminu a Cmax v krvi o 22% a AUC v krvi o 15%, bez jakékoli významné změny renální clearance metforminu. Při podávání s metforminem byly Cmax a AUC furosemidu o 31% a AUC furosemidu o 12% menší, než když podáván samostatně a terminální poločas byl snížen o 32%, bez jakékoli významné změny furosemidového ledvin odbavení. Nejsou k dispozici žádné informace o interakci metforminu a furosemidu při dlouhodobém podávání.
Nifedipin - Jednorázová studie lékové interakce metformin-nifedipin u zdravých dobrovolníků prokázala, že souběžné podávání nifedipinu zvýšilo Cmax metforminu v plazmě o 20% a AUC o 9% a zvýšilo množství vylučuje se močí. Tmax a poločas nebyly ovlivněny. Zdá se, že nifedipin zvyšuje absorpci metforminu. Metformin měl minimální účinky na nifedipin.
Kationická léčiva - kationická léčiva (např. Amilorid, digoxin, morfin, prokainamid, chinidin, chinin, ranitidin, triamteren, trimethoprim nebo vankomycin), která jsou vylučovány renální tubulární sekrecí teoreticky mají potenciál pro interakci s metforminem soutěží o běžný renální tubulární transport systémy. Taková interakce mezi metforminem a perorálním cimetidinem byla pozorována u zdravých dobrovolníků u jednorázové i opakované dávky metformin-cimetidinu studie lékových interakcí se 60% zvýšením maximální koncentrace metforminu v plazmě a plné krvi a 40% zvýšením plazmy a plné krve v metforminu AUC. Ve studii s jednorázovou dávkou nedošlo k žádné změně eliminačního poločasu. Metformin neměl žádný účinek na farmakokinetiku cimetidinu. Přestože takové interakce zůstávají teoretické (s výjimkou cimetidinu), pečlivé sledování pacienta a úprava dávky Glucophage nebo Glucophage XR a / nebo interferující lék se doporučuje u pacientů, kteří užívají kationtové léky vylučované proximální tubulární sekrecí ledvin Systém.
Jiné - Některá léčiva mají tendenci vyvolávat hyperglykémii a mohou vést ke ztrátě glykemické kontroly. Mezi tyto léky patří thiazidy a další diuretika, kortikosteroidy, fenothiaziny, produkty štítné žlázy, estrogeny, orální antikoncepční prostředky, fenytoin, kyselina nikotinová, sympatomimetika, léčiva blokující vápníkový kanál a isoniazid. Pokud jsou takováto léčiva podána pacientovi, který dostává Glucophage nebo Glucophage XR, je třeba pacienta pečlivě sledovat, zda nedochází ke snížení hladiny glukózy v krvi. Pokud jsou takováto léčiva odebrána pacientovi, který dostává Glucophage nebo Glucophage XR, je třeba pacienta pečlivě sledovat na hypoglykémii.
U zdravých dobrovolníků nebyla farmakokinetika metforminu a propranololu a metforminu a ibuprofenu při současném podávání ve studiích interakce s jednou dávkou ovlivněna.
Metformin je zanedbatelně vázán na plazmatické proteiny, a proto je méně pravděpodobné, že bude interagovat s vysoce vázanými proteiny, jako jsou salicyláty, sulfonamidy, chloramfenikol a probenecid ve srovnání se sulfonylmočovinami, které jsou značně vázány na sérum proteiny.
Karcinogeneze, mutageneze, zhoršení plodnosti
Byly provedeny dlouhodobé studie karcinogenity u potkanů (trvání dávky 104 týdnů) a myší (trvání dávky 91 týdnů) v dávkách až do 900 mg / kg / den včetně a 1500 mg / kg / den, resp. Tyto dávky jsou přibližně čtyřnásobkem maximální doporučené denní dávky pro člověka 2000 mg na základě srovnání povrchu těla. U samců nebo samic myší nebyly zjištěny žádné známky karcinogenity s metforminem. Podobně nebyl u samců potkanů pozorován žádný tumorigenní potenciál s metforminem. U samic potkanů léčených 900 mg / kg / den však došlo ke zvýšenému výskytu benigních stromálních děložních polypů.
V následujících testech in vitro nebyl prokázán mutagenní potenciál metforminu: Amesův test (S. S. typhimurium), test genové mutace (buňky myších lymfomů) nebo test chromozomálních aberací (lidské lymfocyty). Výsledky in vivo testu na mikronukleu myší byly také negativní.
Plodnost samců nebo samic potkanů nebyla metforminem ovlivněna, pokud byly podávány v dávkách až 600 mg / kg / den, což je přibližně trojnásobek maximální doporučené denní dávky pro člověka na základě plochy povrchu těla srovnání.
Těhotenství
Teratogenní účinky: Těhotenství Kategorie B
Nejnovější informace silně naznačují, že abnormální hladiny glukózy v krvi během těhotenství jsou spojeny s vyšším výskytem vrozených abnormalit. Většina odborníků doporučuje, aby byl inzulín používán během těhotenství k udržení hladiny glukózy v krvi co nejblíže k normálnímu stavu. Protože studie reprodukce na zvířatech ne vždy predikují lidskou odpověď, neměly by se Glucophage a Glucophage XR používat během těhotenství, pokud to není nezbytně nutné.
Neexistují dostatečné a dobře kontrolované studie u těhotných žen s Glucophage nebo Glucophage XR. Metformin nebyl teratogenní u potkanů a králíků v dávkách až 600 mg / kg / den. To představuje expozici přibližně 2krát a 6krát vyšší než maximální doporučená denní dávka u člověka 2000 mg na základě srovnání povrchu těla pro potkany a králíky. Stanovení fetálních koncentrací prokázalo částečnou placentární bariéru metforminu.
Kojící matky
Studie na laktujících potkanech ukazují, že se metformin vylučuje do mléka a dosahuje srovnatelných hladin v plazmě. Podobné studie nebyly provedeny u kojících matek. Protože u kojících dětí může existovat možnost hypoglykémie, mělo by být rozhodnuto, zda přerušit kojení nebo přerušit užívání léku, s přihlédnutím k důležitosti léku pro léčbu matka. Pokud je léčba Glucophage nebo Glucophage XR přerušena a pokud není dieta sama o sobě pro kontrolu glykémie dostatečná, měla by být zvážena inzulínová terapie.
Pediatrické použití
Bezpečnost a účinnost Glucophage pro léčbu diabetu typu 2 byla stanovena v roce 2006 pediatričtí pacienti ve věku 10 až 16 let (studie u pediatrických pacientů do 10 let nebyly provedeny) let). Použití Glucophage v této věkové skupině je podloženo důkazy z odpovídajících a dobře kontrolovaných studií Glucophage u dospělých s dalšími údaji z kontrolovaná klinická studie u pediatrických pacientů ve věku 10 až 16 let s diabetem 2. typu, která prokázala podobnou odpověď v glykemické kontrole jako u Dospělí. (Vidět KLINICKÁ FARMAKOLOGIE: Pediatrické klinické studie.) V této studii byly nežádoucí účinky podobné účinkům popsaným u dospělých. (Vidět NEŽÁDOUCÍ REAKCE: Pediatričtí pacienti.) Doporučuje se maximální denní dávka 2 000 mg. (Vidět DÁVKOVÁNÍ A PODÁNÍ: Doporučený rozvrh dávkování: Pediatrie.)
Bezpečnost a účinnost Glucophage XR u pediatrických pacientů nebyla stanovena.
Geriatrické použití
Kontrolované klinické studie Glucophage a Glucophage XR nezahrnovaly dostatečný počet starších pacientů, aby bylo možné určit, zda reagují na rozdíl od mladších pacientů, ačkoli jiné uváděné klinické zkušenosti nezjistily rozdíly v odpovědích mezi staršími a mladšími pacientů. Je známo, že metformin je v podstatě vylučován ledvinami, a protože riziko závažných nežádoucích účinků na léčivo je vyšší u pacientů s poškozenou funkcí ledvin by se Glucophage a Glucophage XR měly používat pouze u pacientů s normální funkcí ledvin (viz KONTRAINDIKACE, VAROVÁNÍ, a KLINICKÁ FARMAKOLOGIE: Farmakokinetika). Protože stárnutí je spojeno se sníženou funkcí ledvin, měl by být Glucophage nebo Glucophage XR používán s rostoucím věkem opatrně. Při výběru dávky je třeba postupovat opatrně a musí být založen na pečlivém a pravidelném sledování renálních funkcí. Obecně by starší pacienti neměli být titrováni na maximální dávku Glucophage nebo Glucophage XR (viz také VAROVÁNÍ a DÁVKOVÁNÍ A PODÁNÍ).
horní
Nežádoucí reakce
V americké dvojitě zaslepené klinické studii Glucophage u pacientů s diabetem 2. typu dostávalo celkem 141 pacientů terapii Glucophage (až do 2550 mg denně) a 145 pacientů dostávalo placebo. Nežádoucí účinky hlášené u více než 5% pacientů s glukofágem, které byly častější u pacientů léčených glukofágem než u pacientů léčených placebem, jsou uvedeny v tabulce 11.
Tabulka 11: Nejčastější nežádoucí reakce (> 5,0%) v placebem kontrolované klinické studii monoterapie glukofágem *
| Nežádoucí reakce | Glukofág Monoterapie (n = 141) |
Placebo (n = 145) |
|---|---|---|
| % pacientů | ||
| * Reakce, které byly častější u pacientů léčených glukofágem než u pacientů léčených placebem. | ||
| Průjem | 53.2 | 11.7 |
| Nevolnost / zvracení | 25.5 | 8.3 |
| Nadýmání | 12.1 | 5.5 |
| Astenie | 9.2 | 5.5 |
| Špatné trávení | 7.1 | 4.1 |
| Obtíže v oblasti břicha | 6.4 | 4.8 |
| Bolest hlavy | 5.7 | 4.8 |
Průjem vedl k přerušení léčby studiem u 6% pacientů léčených glukofágem. Dále byly hlášeny následující nežádoucí účinky u 1,0% až 5,0% pacientů s glukofágem a častěji byly hlášeny s glukofágem než placebem: abnormální stolice, hypoglykémie, myalgie, světlice, dušnost, porucha nehtů, vyrážka, zvýšené pocení, porucha chuti, nepohodlí na hrudi, zimnice, chřipkový syndrom, návaly horka, palpitace.
V celosvětových klinických studiích bylo více než 900 pacientů s diabetem 2. typu léčeno Glucophage XR ve studiích kontrolovaných placebem a aktivně. V placebem kontrolovaných studiích bylo 781 pacientů léčeno Glucophage XR a 195 pacientů dostávalo placebo. Nežádoucí účinky hlášené u více než 5% pacientů s Glucophage XR, které byly častější u pacientů s Glucophage XR než u pacientů léčených placebem, jsou uvedeny v tabulce 12.
Tabulka 12: Nejčastější nežádoucí reakce (> 5,0%) v placebem kontrolovaných studiích Glucophage XR *
| Nežádoucí reakce | Glucophage XR (n = 781) |
Placebo (n = 195) |
|---|---|---|
| % pacientů | ||
| * Reakce, které byly častější u pacientů léčených Glucophage XR, než u pacientů léčených placebem. | ||
| Průjem | 9.6 | 2.6 |
| Nevolnost / zvracení | 6.5 | 1.5 |
Průjem vedl k přerušení léčby studiem u 0,6% pacientů léčených Glucophage XR. Dále byly hlášeny následující nežádoucí účinky u 1,0% až 5,0% pacientů s Glucophage XR a častěji byly hlášeny u Glucophage XR než placebo: bolest břicha, zácpa, distenze břicha, dyspepsie / pálení žáhy, nadýmání, závratě, bolesti hlavy, infekce horních cest dýchacích, chuť rušení.
Pediatričtí pacienti
V klinických studiích s Glucophage u pediatrických pacientů s diabetem typu 2 byl profil nežádoucích účinků podobný jako u dospělých.
horní
Předávkovat
Došlo k předávkování hydrochloridem metforminu, včetně požití množství větších než 50 gramů. Hypoglykémie byla hlášena přibližně v 10% případů, ale nebyla prokázána žádná příčinná souvislost s hydrochloridem metforminu. Laktátová acidóza byla hlášena přibližně u 32% případů předávkování metforminem (viz VAROVÁNÍ). Metformin je dialyzovatelný s clearance až 170 ml / min za dobrých hemodynamických podmínek. Proto může být hemodialýza užitečná pro odstranění nahromaděného léčiva od pacientů, u nichž existuje podezření na předávkování metforminem.
horní
Dávkování a správa
Pro léčbu hyperglykémie u pacientů s diabetem typu 2 s Glucophage nebo Glucophage XR nebo s jakýmkoli jiným farmakologickým přípravkem není stanoven žádný pevný dávkovací režim. Dávkování Glucophage nebo Glucophage XR musí být individualizováno na základě účinnosti i tolerance, přičemž nesmí překročit maximální doporučené denní dávky. Maximální doporučená denní dávka Glucophage je 2550 mg u dospělých a 2000 mg u pediatrických pacientů (ve věku 10 až 16 let); maximální doporučená denní dávka Glucophage XR u dospělých je 2000 mg.
Glucophage by měl být podáván v rozdělených dávkách s jídlem, zatímco Glucophage XR by měl být obvykle podáván jednou denně s večerním jídlem. Glucophage nebo Glucophage XR by měl být zahájen nízkou dávkou, s postupným zvyšováním dávky, a to za účelem snížení gastrointestinální vedlejší účinky a umožňující identifikaci minimální dávky potřebné pro odpovídající kontrolu glykémie pacienta.
Během zahájení léčby a titrace dávky (viz Doporučený dávkovací režim níže) by měla být hladina glukózy v plazmě nalačno používá se ke stanovení terapeutické odpovědi na Glucophage nebo Glucophage XR a k určení minimální účinné dávky pro Glucophage trpěliví. Poté by měl být glykosylovaný hemoglobin měřen v intervalech přibližně 3 měsíců. Terapeutickým cílem by mělo být snížení plazmatické glukózy nalačno i glykosylovaných hladin hemoglobinu na normální nebo téměř normální úroveň používající nejnižší účinnou dávku Glucophage nebo Glucophage XR, a to buď při monoterapii, nebo v kombinaci se sulfonylmočovinou nebo inzulín.
Sledování hladiny glukózy v krvi a glykosylovaného hemoglobinu také umožní detekci primárního selhání, tj. Nedostatečné snížení hladiny glukózy v krvi na maximální doporučená dávka léku a sekundární selhání, tj. ztráta adekvátní odpovědi na snížení hladiny glukózy v krvi po počátečním období účinnost.
Krátkodobé podávání Glucophage nebo Glucophage XR může být dostatečné během období přechodné ztráty kontroly u pacientů obvykle dobře kontrolovaných dietou samotnou.
Tablety Glucophage XR se musí polykat celé a nikdy se nedrtí ani nežvýkají. Neaktivní složky Glucophage XR budou občas vyloučeny ve stolici jako měkká, hydratovaná hmota.
Doporučený dávkovací rozvrh
Dospělí
Obecně nejsou klinicky významné reakce pozorovány při dávkách pod 1500 mg za den. Doporučuje se však nižší doporučená počáteční dávka a postupně se zvyšující dávka, aby se minimalizovaly gastrointestinální příznaky.
Obvyklá počáteční dávka tablet Glucophage (metformin hydrochloride) je 500 mg dvakrát denně nebo 850 mg jednou denně, podávaná s jídlem. Zvýšení dávky by mělo být zvyšováno o 500 mg týdně nebo 850 mg každé 2 týdny, až do celkové dávky 2000 mg denně, rozdělených do několika dávek. Pacienti mohou být titrováni také od 500 mg dvakrát denně do 850 mg dvakrát denně po 2 týdnech. U pacientů, kteří vyžadují další kontrolu glykémie, může být Glucophage podán v maximální denní dávce 2550 mg denně. Dávky nad 2000 mg mohou být lépe snášeny při podávání 3krát denně s jídlem.
Obvyklá počáteční dávka přípravku Glucophage XR (metformin hydrochloride) s prodlouženým uvolňováním je 500 mg jednou denně při večerním jídle. Zvýšení dávky by mělo být zvyšováno o 500 mg týdně až do maxima 2000 mg jednou denně při večerním jídle. Pokud není dosaženo glykemické kontroly na Glucophage XR 2000 mg jednou denně, měla by být zvážena zkouška na 1000 mg Glucophage XR dvakrát denně. Pokud jsou vyžadovány vyšší dávky metforminu, měl by být Glucophage použit v celkových denních dávkách až do 2550 mg podávaných v rozdělených denních dávkách, jak je popsáno výše. (Vidět KLINICKÁ FARMAKOLOGIE: Klinické studie.)
V randomizované studii byli pacienti v současnosti léčeni Glucophage přeřazeni na Glucophage XR. Výsledky této studie naznačují, že u pacientů, kteří dostávají léčbu Glucophage, lze bezpečně přejít na Glucophage XR jednou denně ve stejné celkové denní dávce až do 2 000 mg jednou denně. Po přechodu z Glucophage na Glucophage XR je třeba pečlivě sledovat glykemickou kontrolu a podle toho upravit dávkování (viz. KLINICKÁ FARMAKOLOGIE: Klinické studie).
Pediatrie
Obvyklá počáteční dávka Glucophage je 500 mg dvakrát denně, podávaná s jídlem. Zvýšení dávky by mělo být zvyšováno o 500 mg týdně až do maxima 2 000 mg denně, rozděleno na jednotlivé dávky. Bezpečnost a účinnost Glucophage XR u pediatrických pacientů nebyla stanovena.
Přenos z jiné antidiabetické terapie
Při převodu pacientů ze standardních perorálních hypoglykemických látek jiných než chlorpropamid na Glucophage nebo Glucophage XR není obecně nutné žádné přechodné období. Při převodu pacientů z chlorpropamidu je třeba během prvních 2 týdnů postupovat opatrně, protože prodloužená retence chlorpropamidu v těle, což vede k překrývání účinků léků a možné hypoglykémii.
Současná léčba glukofágem nebo glukofágem XR a perorální sulfonylmočovina u dospělých pacientů
Pokud pacienti neodpověděli na 4 týdny maximální dávky Glucophage nebo Glucophage XR monoterapie, mělo by se zvážit postupné přidávání orální sulfonylmočovina při současném pokračování Glucophage nebo Glucophage XR v maximální dávce, i když předchozí primární nebo sekundární selhání sulfonylmočoviny má došlo. Údaje o klinických a farmakokinetických interakcích léčivo-léčivo jsou v současné době k dispozici pouze pro metformin plus glyburid (glibenklamid).
Při současné terapii Glucophage nebo Glucophage XR a sulfonylmočovinou lze požadovanou kontrolu hladiny glukózy v krvi získat úpravou dávky každého léčiva. V klinické studii u pacientů s diabetem 2. typu a předchozím selháním glyburidu byli pacienti na Glucophage 500 mg a 20 mg glyburidu titrováni na 1 000/20 mg, 1500/20 mg, 2000/20 mg nebo 2500/20 mg Glucophage a glyburidu, v daném pořadí, k dosažení cíle glykemické kontroly měřené pomocí FPG, HbA1c a plazmatické glukózové odpovědi (vidět KLINICKÁ FARMAKOLOGIE: Klinické studie). K dosažení tohoto cíle by však měly být provedeny pokusy o určení minimální účinné dávky každého léčiva. Při současné léčbě Glucophage nebo Glucophage XR a sulfonylmočovinou riziko hypoglykémie spojené s terapií sulfonylmočovinou přetrvává a může být zvýšeno. Měla by být přijata vhodná opatření. (Viz příbalový leták příslušné sulfonylmočoviny.)
Pokud pacienti nereagovali uspokojivě na 1 až 3 měsíce souběžné léčby maximální dávkou Glucophage nebo Glucophage XR a maximální dávka perorální sulfonylmočoviny, zvažte terapeutické alternativy včetně přechodu na inzulín s nebo bez Glucophage nebo Glucophage XR.
Současná léčba pomocí Glucophage nebo Glucophage XR a inzulinová terapie u dospělých pacientů
Současná dávka inzulínu by měla pokračovat i po zahájení léčby Glucophage nebo Glucophage XR. U pacientů na inzulínové terapii by měla být léčba glukofágem nebo Glucophage XR zahájena dávkou 500 mg jednou denně. U pacientů, kteří neodpovídají adekvátně, by měla být dávka Glucophage nebo Glucophage XR zvýšena o 500 mg přibližně po 1 týdnu a 500 mg každý týden poté, dokud není dosaženo dostatečné kontroly glykémie bylo dosaženo. Maximální doporučená denní dávka je 2500 mg pro Glucophage a 2000 mg pro Glucophage XR. Při plazmatické glukóze nalačno se doporučuje snížit dávku inzulínu o 10% až 25% koncentrace klesají na méně než 120 mg / dl u pacientů užívajících současně inzulín a glukofág nebo Glucophage XR. Další úpravy by měly být individualizovány na základě reakce na snížení hladiny glukózy.
Specifické populace pacientů
Glucophage nebo Glucophage XR se nedoporučuje používat v těhotenství. Glukofág se nedoporučuje u pacientů mladších 10 let. Glucophage XR se nedoporučuje u pediatrických pacientů (mladších 17 let).
Počáteční a udržovací dávka Glucophage nebo Glucophage XR by měla být u pacientů s pokročilým věkem konzervativní vzhledem k možnosti snížené funkce ledvin v této populaci. Jakákoli úprava dávky by měla být založena na pečlivém posouzení funkce ledvin. Obecně by starší, oslabení a podvyživení pacienti neměli být titrováni na maximální dávku Glucophage nebo Glucophage XR.
Monitorování renálních funkcí je nezbytné pro prevenci laktátové acidózy, zejména u starších osob. (Vidět VAROVÁNÍ.)
horní
Jak dodáván
Tablety Glucophage® (metformin hydrochloride)
| 500 mg | Lahve po 100 | NDC 0087-6060-05 |
| 500 mg | Lahve po 500 | NDC 0087-6060-10 |
| 850 mg | Lahve po 100 | NDC 0087-6070-05 |
| 1000 mg | Lahve po 100 | NDC 0087-6071-11 |
Tablety Glucophage 500 mg jsou kulaté, bílé až téměř bílé, potahované tablety s vyraženým „BMS“ 6060 "kolem okraje tablety na jedné straně a" 500 "vyražených přes druhou stranu postranní.
Tablety Glucophage 850 mg jsou kulaté, bílé až téměř bílé, potahované tablety s vyraženým „BMS“ 6070 "kolem okraje tablety na jedné straně a" 850 "vyražených přes druhou stranu postranní.
Tablety Glucophage 1000 mg jsou bílé, oválné, bikonvexní, potahované tablety s vyraženým „BMS 6071“ na jedné straně a „1000“ vyraženým na opačné straně a na obou stranách s přerušovanou čarou.
Tablety Glucophage® XR (metformin hydrochloride) s prodlouženým uvolňováním
| 500 mg | Lahve po 100 | NDC 0087-6063-13 |
| 750 mg | Lahve po 100 | NDC 0087-6064-13 |
Tablety Glucophage XR 500 mg jsou bílé až téměř bílé, bikonvexní tablety ve tvaru tobolky, na jedné straně vyraženo „BMS 6063“ a na druhé straně vyraženo „500“.
Tablety Glucophage XR 750 mg jsou bikonvexní tablety ve tvaru tobolek s vyraženým „BMS 6064“ na jedné straně a „750“ na druhé straně. Tablety jsou světle červené a mohou mít skvrnitý vzhled.
Úložný prostor
Skladujte při 20 ° -25 ° C (68 ° -77 ° F); dovolené výlety do 15 ° - 30 ° C (59 ° - 86 ° F). [Viz USP řízená pokojová teplota.]
Výdej v nádobách odolných proti světlu.
Glucophage® je registrovaná ochranná známka společnosti Merck Santà S. S. S., spolupracovníka společnosti Merck KGaA v německém Darmstadtu. Licencováno pro společnost Bristol-Myers Squibb.
Distribuovány:
Společnost Bristol-Myers Squibb
Princeton, NJ 08543 USA
poslední aktualizace: 01/2009
Glucohage, metformin hydrochloride, informace o pacientech (v prosté angličtině)
Podrobné informace o příznacích, příznacích, příčinách, léčbě cukrovky
Účelem informací v této monografii není pokrýt všechna možná použití, pokyny, preventivní opatření, lékové interakce nebo nepříznivé účinky. Tyto informace jsou zobecněné a neslouží jako zvláštní lékařská pomoc. Máte-li dotazy týkající se léků, které užíváte, nebo byste chtěli získat více informací, obraťte se na svého lékaře, lékárníka nebo zdravotní sestru.
zpět k: Procházet všechny léky na cukrovku

